00 Recommandation - Revues Scientifiques Marocaines

302 Maroc Médical, tome 26 n°4, décembre 2004
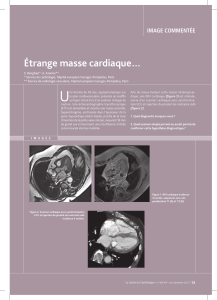
Embolie coronaire révélant un
rétrécissement mitral
Coronary embolus revealing a mitral
stenosis
L. Marmade, M. Elkouache, M. Laaroussi, M. Tribak, K. Baghdadi, S. Moughil, A. Benomar, J. Filal, Mh. Benomar.
Service de chirurgie cardio-vasculaire “B” hôpital Ibn Sina
…ΟG Ωɪ°üdG ≥«°†J øY ∞°ûμj »LÉJ Ωɪ°üfG
Lettre à la rédaction
Introduction
Dans le contexte marocain d’endémie de rhumatisme
articulaire aigu (RAA), le rétrécissement mitral (RM) est
la valvulopathie la plus fréquente. Le RM est surtout
connu par ses conséquences d’amont parmi lesquelles
figurent en premier les troubles de rythme auriculaire à
type de fibrillation auriculaire (FA) et les embolies
systémiques. Ces dernières sont fréquentes au niveau
cérébral et très rares au niveau coronaire [1].
Nous rapportons le cas d’un patient chez qui le RM est
révélé par une embolie coronaire ayant engendré un
infarctus du myocarde (IDM) postéro-inférieur.
Observation
Il s’agissait d’un patient de 42 ans, ayant comme
antécédent un épisode de RAA dans l’enfance et comme
facteurs de risque cardiovasculaire, hormis l’âge et le sexe,
un tabagisme chronique à trois paquets / année sevré
depuis un an. L’histoire de la maladie remontait à trois
mois par la survenue d’un malaise avec perte de
connaissance accompagnés de douleurs angineuses
typiques au repos, intenses et prolongées.
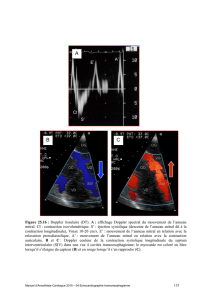
L’électrocardiogramme (ECG) (figure 1) a montré une
arythmie complète par fibrillation auriculaire (ACFA), une
hypertrophie de l’oreillette gauche (OG) et un sus-
décalage de ST de 2 mm en inférieur (figure 1). La biologie
a objectivé une élévation des enzymes cardiaques (CPK à
280 UI/L, CPK mb à 75 UI/L). L’échocardiographie
transthoracique (ETT) a montré une contractilité globale et
segmentaire correctes mis à part une hypokinésie de la
paroi inférieure, une maladie mitrale à prédominance de
sténose (surface mitrale à 0,9 cm_, gradient maximal à 30
mmHg), un contraste spontané au niveau de l’OG et une
insuffisance aortique (IAo) minime.
Après son admission dans une structure hospitalo-
universitaire où le diagnostic d’IDM postéro-inférieur a été
posé, le patient a été stabilisé sous traitement conventionnel.
Trois mois plus tard, le malade a été adressé au service
de chirurgie cardiovasculaire pour cure chirurgicale de sa
valvulopathie mitrale.
A l’admission, le patient était apyrétique, dyspnéique stade
III de la NYHA, avec une tension artérielle à 110 / 65
mmHg, un pouls irrégulier à 80 bm / min et sans signes
périphériques d’insuffisance cardiaque. La radiographie
pulmonaire a montré une cardiomégalie (index cardiothoracique
à 0,60), un aspect de double contours et un poumon mitral.
L’ECG a montré une ACFA à 80 cycles / min avec un aspect
qs en inférieur. L’ETT et l’échocardiographie transoesophagienne
(ETO) ont confirmé l’existence d’une maladie mitrale à
prédominance de sténose, d’une OG dilatée avec un
thrombus au niveau de l’auricule et de la paroi de l’OG. Par
ailleurs, l’IAo était minime , la pression artérielle pulmonaire
systolique était à 40 mmHg. La coronarographie s’est révélée
normale (figure 2). La biologie a montré une normalisation
des enzymes cardiaques.
Le patient a été opéré sous circulation extracorporelle.
Nous avons mis en évidence une thrombose massive
tapissant l’auricule et l’oreillette gauches. Nous avons
Figure 1. ECG

Maroc Médical, tome 26 n°4, décembre 2004 303
M. Marmade
et coll.
Embolie coronaire révélant un rétrécissement mitral
procédé à une thrombectomie et à un remplacement
valvulaire mitral par une valve mécanique ATS _ 29.
Les suites opératoires étaient relativement simples mis à
part une atélectasie de la base pulmonaire droite. L’ETT
postopératoire a montré un bon fonctionnement de la
prothèse mitrale avec une fuite aortique inchangée. Le
recul à quatre mois était satisfaisant.
Discussion
L’embolie systémique peut avoir comme point de départ
une thrombose souvent localisée à l’auricule, parfois
tapissant une paroi de l’OG, exceptionnellement massive.
L’incidence de l’embolie systémique est de 9,6 à 18 %
dans les séries chirurgicales [1, 2], et est de 41 % dans les
séries autopsiques [3]. Le principal facteur favorisant est la
survenue préalable d’une FA qui est notée dans 90 % des
cas au moment de l’embolie. Un rythme sinusal ne peut
éliminer une FA paroxystique précédant l’accident
embolique. L’incidence de la FA augmente avec l’évolution
du RM et avec l’âge du patient [4]. Le risque embolique
est sept fois plus grand chez les patients avec
valvulopathie mitrale rhumatismale en FA que chez ceux
en rythme sinusal [5]. Au delà de 35 ans, un malade sur 3
en FA a présenté une embolie systémique [6]. Cette
dernière, peut révéler un RM jusqu’au là méconnu [7].
Chez notre patient, c’est l’accident embolique qui a révélé
le RM en FA. Le degré de sténose n’est pas corrélé au
risque thromboembolique [8]. Les embolies systémiques
sont souvent cérébrales (60 % des cas), parfois artérielles
au niveau des membres inférieurs, viscérales, voire
coronaires [1]. Les artères coronaires sont particulièrement
protégées contre les événements thromboemboliques du
fait de l’angulation existant entre les ostia coronaires et le
flux de l’aorte, et du fait de la situation des ostia derrière
les sigmoïdes aortiques correspondantes pendant la
systole. Lorsque survient une embolie coronaire,
l’évolution dépend de la taille de l’embol et de sa
localisation à l’intérieur du lit coronaire. Les petits embols,
assez fréquents, peuvent entraîner une occlusion d’une
branche distale (le plus souvent l’interventriculaire
antérieure [9]) qui, cliniquement, peut passer inaperçue
[10, 11]. Les gros embols, plus rares, entraînent
généralement un IDM cliniquement apparent. C’est le cas
de notre patient chez qui l’embol est plutôt parti au niveau
de la coronaire droite et qui a engendré un IDM postéro-
inférieur avec un tableau clinique bruyant. Le diagnostic
de cette nécrose myocardique est d’ailleurs retenu sur les
données électriques (sus décalage de ST), biologiques
(élévation des enzymes cardiaques) et échocardiographiques
(hypokinésie inférieure).
Les embols coronaires sont un diagnostic différentiel de
l’IDM aigu chez les patients dont l’histoire clinique
prédispose aux embols artériels, notamment chez les patients
ayant une valvulopathie (endocardite, anomalie valvulaire
non infectée, prothèse valvulaire), un thrombus mural
(cardiomyopathie congestive, IDM antérieur, FA), un
cathétérisme cardiaque gauche [10 - 12] ou la possibilité
anatomique d’une embolie paradoxale par le biais d’un
foramen ovale persistant [13]. Notre patient n’a jamais fait de
cathétérisme cardiaque gauche avant son admission pour
IDM. En outre, l’ETO montre un ventricule gauche de
contractilité conservée et libre de thrombus, une cloison
interauriculaire intacte. L’embol, du fait du RM associé à la
thrombose massive, vient à fortiori de l’OG.
L’embol est le plus souvent un thrombus récent à
prédominance de fibrine [9].
Chez certains patients, une angiographie coronaire
précoce permet de retrouver une occlusion du vaisseau
atteint, mais une nouvelle angiographie dans le mois qui
suit peut montrer une reperméation du vaisseau atteint
Figure 2. Coronarographie

304 Maroc Médical, tome 26 n°4, décembre 2004
Embolie coronaire révélant un rétrécissement mitral M. Marmade
et coll.
résultant de la lyse ou de la recanalisation de l’embol [10].
C’est le cas de notre patient chez qui une coronarographie
faite six semaines après l’IDM, a montré un réseau
coronaire normal. Les embolies systémiques représentent,
après l’insuffisance cardiaque, la deuxième cause de
mortalité des malades atteints de RM non opérés. Elles
sont responsables lors d’un accident de 15 à 30 % de décès
[14]. Pour diminuer du risque de récidive de l’embolie,
surtout accru durant la première année suivant l’accident
embolique, les auteurs recommandent une anticoagulation
au long cours par antivitamines K pour toute valvulopathie
mitrale rhumatismale en FA paroxystique ou chronique et
avec une histoire d’embolie systémique (grade 1C+) [4].
Le rôle de la chirurgie cardiaque dans le traitement des
embols coronaires aigus reste à être défini [13, 15]. En effet,
le bénéfice des alternatives thérapeutiques instrumentales et
ou chirurgicales dans ces cas particuliers d’IDM à
coronaires saines, n’est pas démontré.
Conclusion
L’embolie coronaire secondaire à un RM et ayant
entraîné un IDM est très rare. Elle peut être révélatrice
d’un RM. Le diagnostic est rétrospectivement établi sur les
critères électriques, biologiques et échocardiographiques.
La prise en charge est médico-chirurgicale et doit être
urgente. Elle concerne d’abord l’IDM ensuite le RM. La
prévention passe par un diagnostic et une prise en charge
des RM qui doivent être précoces et efficaces.
Références
1. Soulié P, Chiche P, Degeorges M, Acar J, Benceraf A.
Etude sur les embolies artérielles périphériques du
rétrécissement mitral et leur traitement par les
anticoagulants. Sem Hop Paris 1960 ; 60 : 2753-57.
2. Ellis LB, Harken DE. Arterial embolization in relation
to mitral valvuloplasty. Am Heart J 1961 ; 62 : 611-13.
3. Hinton RC, Kistler JP, Fallon JJ. Influence of etiology
of atrial fibrillation on incidence of systemic embolism.
Am J Cardiol 1977 ; 40 : 509-13.
4. Salem DN, Daudelin DH, Levine HJ, Pauker SG,
Eckman MH, Riff J. Antithrombotic therapy in valvular
heart disease. Chest 2001 ; 119 : 207S-219S.
5. Szekely P. Systemic embolism and anticoagulant
prophylaxis in rheumatic heart disease. Br Med J 1964 ; 1
: 209-12.
6. Coulshed N, Epstein EJ, Mc Kendrick CS, Galloway
RW, Walker E. Systemic embolism in mitral valve disease.
Br Heart J 1970 ; 32 : 26-34.
7. Fouchard J, Lazarus A, Py A, Lombard E, Guerin F.
Coronary embolism revealing mitral valve stenosis. Press
Med 1994 ; 23 : 35-7.
8. Bannister RG. The risk of differing valvotomy in
patients with moderate mitral stenosis. Lancet 1960 ; 2 :
329-332.
9. Loire R, Tabib A. Coronary embolism. A propos of 61
anatomo-clinical cases. Arch Mal Coeur Vaiss 1985 ; 78 :
821-27.
10. Roberts WC. Coronary embolism : a review of
causes, consequences and diagnostic considerations.
Cardiovasc Med 1978 ; 3 : 699-704.
11. Prizel KR, Hutchins GM, Bulkley BH. Coronary
artery embolism and myocardial infarction. Ann Intern
Med 1978 ; 88 : 155-59.
12. Bochna AJ, Falicov RE. Diagnosis of intracardiac
thrombi in mitral stenosis and left ventricular dysfunction.
Use of selective coronary arteriography. Arch Int Med
1980 ; 140 : 759-762.
13. Meier B, Lock JE. Traitement actuel du foramen
ovale perméable. Circulation 2003 ; 107 : 5-9.
14. Rowe JC, Bland EF, Sprague HB, White PD. The
course of mitral stenosis without surgery : ten and twenty
year perspectives. Ann Int Med 1960 ; 52 : 741-746.
15. Dearani JA, Ugurlu BS, Danielson GK, Daly RC,
McGregor Christopher GA, Mullany CJ et al. Surgical
patent foramen ovale closure for prevention of paradoxical
embolism-related cerebro-vascular ischemic events.
Circulation 1999 ; 100(suppl II) : II171-II175.
1
/
3
100%