L` EQUILIBRE ESTERIFICATION

L' EQUILIBRE ESTERIFICATION - HYDROLYSE
à Equation chimique associée
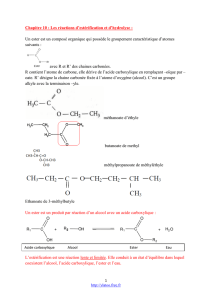
- L'estérification est la réaction d'un acide carboxylique avec un alcool et conduit à un ester carboxylique et de l'eau.
- L'hydrolyse est la réaction d'un ester carboxylique avec de l'eau et conduit à un acide carboxylique et un alcool.
L'équation chimique modélisant ces réactions s'écrit :
R C OH + R' OH R C OR' + H2O
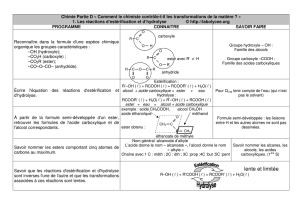
à Suivi cinétique de la réaction
Le suivi cinétique de la réaction, c'est-à-dire l'évolution de l'avancement x(t) de la réaction s'effectue par dosage
acido-basique de l'acide carboxylique à chaque instant.
L'acide est formé dans le cas de l'hydrolyse ou détruit dans le cas de l'estérification.
L'équation associée à ce dosage s'écrit : RCOOH + HO-à RCOO- + H2O
A l'équivalence, les réactifs sont introduits dans les proportions stoechiométriques d'où :
n(acide restant ou formé) = n(hydoxyde versé) donc - pour l'estérification :
0
A
n
- x(t) = CB .VB,eq
- pour l'hydrolyse : x(t) = CB . VB,eq
Remarque : si la réaction a été catalysée par un acide, il faut travailler sur la quantité d'ions hydroxyde servant
exclusivement au dosage de l'acide carboxylique.
à Caractéristiques de la réaction
Les réactions d'estérification et d'hydrolyse sont des réactions lentes, limitées et athermiques
Ÿ Contrôle de la vitesse de réaction :
- utilisation d'un catalyseur ( généralement acide sulfurique) pas de modification de l'état final
- élever la température
Ÿ Contrôle de l'état final
Le rendement de la réaction d'estérification est r =
final ou équilibre
max ou théorique
x
x. Il est de 67% avec un alcool primaire, de 60% avec
un alcool secondaire et de l'ordre de 5% avec un alcool tertiaire.
Ce rendement peut être augmenté :
- en augmentant la proportion d'un des réactifs par rapport à l'autre ( critère évolution spontanée)
- en prélevant l'un des produits au cours de sa formation
------------------------------------------------------------------------------------------------------------------------------------
O
O
1
/
1
100%