Mécanisme réactionnel de l`oxydation de Swern

Complément – Chapitre 10
Alcools, phénols et thiols
Mécanisme réactionnel de l’oxydation de Swern
L’oxydation de Swern est une oxydation douce qui permet d’obtenir des aldéhydes à
partir d’alcools primaires ou des cétones à partir d’alcools secondaires. Les aldéhydes
ne sont pas davantage oxydés en acides carboxyliques. De plus, cette oxydation ne
nécessite pas l’utilisation du chrome, un métal toxique. La réaction globale de cette
réaction est présentée à la figure 10.a. La température doit être maintenue très basse
pour éviter toute explosion possible.
Figure 10.a Réaction globale de l’oxydation de Swern
RCH
2OH
Et3N, CH2Cl2, -60 oC
RC
O
H
Alcool primaire
SH3C
O
CH3
(DMSO)
CCl
O
C
(chlorure d'oxalyle)
O
Cl
,
Aldéhyde
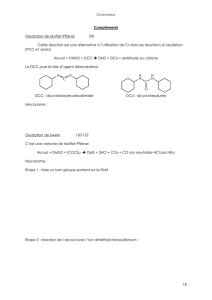
Cette réaction peut se subdiviser en deux parties. La première partie consiste à
présenter comment le diméthylsulfoxyde (DMSO) réagit avec le chlorure d’oxalyle
pour former l’ion diméthylchlorosulfonium présenté à la figure 10.b. La première
étape du mécanisme consiste en une attaque de l’oxygène du DMSO sur l’un des
carbones très électrophiles des deux groupements carbonyles du chlorure d’oxalyle.
Puisque le chlore est un bon groupement partant, il est expulsé après l’attaque. L’ion
chlorure peut attaquer à son tour le soufre (atome électrophile) de manière irréversible
pour générer deux gaz, le CO2 et le CO, un ion chlorure Cl- ainsi que le réactif de
Swern, l’ion diméthylchlorosulfonium.
Chimie organique 1 – Chapitre 10 – Complément © 2008 Les Éditions de la Chenelière inc. 1

Figure 10.b Première partie du mécanisme de l’oxydation de Swern ;
formation de l’ion diméthylchlorosulfonium
CH3S
O
CH3
+
_
+Cl C
O
C
O
Cl Cl C
O
C
O
Cl
O
SCH
3
CH3
+
_
OC
O
C
O
ClS
CH3
CH3
+
DMSO
chlorure d'oxalyle
Cl _+
CH3S
Cl
CH3
+
+ CO2 + CO + Cl _
ion diméthylchlorosulfonium
La deuxième partie du mécanisme est la formation du produit final, l’aldéhyde ou la
cétone (voir la figure 10.c). Pour ce faire, l’oxygène de l’alcool (primaire ou
secondaire) attaque le soufre chargé positivement de l’ion diméthylchlorosulfonium
(on parle souvent de DMSO activé). Le chlore est ainsi expulsé et un ion
alkoxysulfonium est formé. Par la suite, la triéthylamine (une base) arrache un
premier hydrogène sur l’ion oxonium, puis un second sur l’un des méthyles pour
former un ylure desulfonium. Par une réaction concertée intramoléculaire et un état de
transition cyclique à cinq atomes, l’aldéhyde (ou la cétone) est synthétisé après que le
carbanion a, à son tour, arraché un hydrogène et généré la formation d’un lien π entre
la liaison C–O. Un des désavantages de cette réaction est la formation du
diméthylsoufre, un produit secondaire dégageant une odeur nauséabonde.
Chimie organique 1 – Chapitre 10 – Complément © 2008 Les Éditions de la Chenelière inc. 2

Figure 10.c Deuxième partie du mécanisme de l’oxydation de Swern ;
obtention du produit final
(aldéhyde ou cétone selon l’alcool de départ)
CH3S
Cl
CH3
+
RC
H
O
H
H+RC
H
O
H
S
H
CH3
CH3
++ +Cl _
RC
H
O
H
SCH
3
C
Et3N
HH
H
Et3N
+
RC
O
H
Aldéhyde
+
CH3SCH
3
diméthylsoufre
RC
H
O
H
SCH
3
CH
H
_+
Ylure de sulfomium
Chimie organique 1 – Chapitre 10 – Complément © 2008 Les Éditions de la Chenelière inc. 3
1
/
3
100%