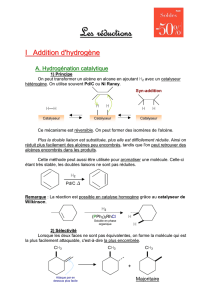
File

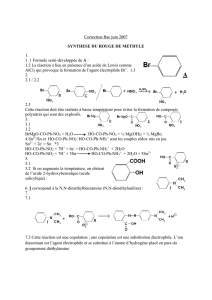
Correction Bac Antilles 2005
SYNTHESE D’UN REPULSIF D’INSECTE : L’E.H.D.
1.
1.1. Le test positif à la 2,4-dinitrophénylhydrazine montre que le composé A est un
aldéhyde ou une cétone. Le test positif à la liqueur de Fehling montre que le composé
A est un aldéhyde.
1.2.
1.2.1.
Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O *1
H3C-CH2-CH2-CHO + 2H+ + 2e- = H3C-CH2-CH2-CH2-OH *3
3 H3C-CH2-CH2-CH2-OH + Cr2O72- + 8H+ 3 H3C-CH2-CH2-CHO + 7 H2O
+ 2Cr3+
1.2.2. Le composé A correspond au butanal.
1.3. Les atomes d’hydrogène portés par le carbone en alpha d’un groupe carbonyle
sont mobiles ; le départ d’un proton donne naissance à
un ion énolate
1.4. B est un aldol :
1.5. Le composé C correspond au 2-éthylhexane-
1,3-diol.
2.
2.1. Formule semi-développée de E : H3C-CH2-CH2- CH2-O-MgBr
2.2. (a) : HBr à basse température. // (b) : magnésium Mg en présence d’éther
oxyde en milieu anhydre et exempt d’air // (c) : oxydant doux comme l’acide
perbenzoïque ou dioxygène à 170°C avec un catalyseur à base d’argent // (d) : eau
H2O.

AUTOUR D’UN PRODUIT DE L’INDUSTRIE DES COSMETIQUES
1.
1.1. La réaction est une saponification.
1.2.
1.3. Q correspond au phénylméthanol ou alcool
benzylique
2. Formule semi-développée de l’acide cinnamique :
3.
3.1.
3.1.1. R correspond au méthylbenzène ou toluène.
3.1.2.
3.1.3. Le chlorure d’aluminium est un acide de Lewis (espèce susceptible de capter un
doublet électronique); il permet la formation de l’espèce électrophile
intermédiaire : AlCl3 + CH3-Cl (+)CH3 + AlCl4-
3.1.4. L’espèce électrophile intermédiaire est le carbocation (+)CH3.
3.1.5. Les deux produits secondaires les plus probables sont les
isomère ortho et para car le groupement méthyle est activant
et oriente en ortho et para :
3.2.
3.2.1. S correspond au chlorophénylméthane
ou chlorure de benzyle.
3.2.2.
3.2.3. Cette réaction correspond à une substitution radicalaire.
3.3.
4.
4.1.
4.2. Cette réaction est une estérification qui est une réaction lente, athermique et
limitée.
4.3. On utilise comme catalyseur de l’acide sulfurique et/ou l’augmentation de la
température pour augmenter la vitesse de la réaction et atteindre l’équilibre plus
rapidement. On peut déplacer l’équilibre en mettant un des réactifs en excès et/ou en
chassant un des produits.
1
/
2
100%