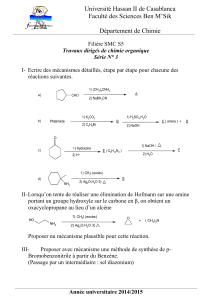
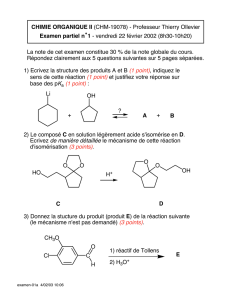
Les composés oxygénés - exercices supplémentaires avec la

3OS
Exercices supplémentaires
Les alcools
1. Combien d'alcools de formule brute C4H10O existe-t-il ? Donnez le nom et la classe
(primaire, secondaire, tertiaire) de ces molécules d'alcools.
2. Nommer les composés suivants :
3. Ecrire les formules semi-développées des composés suivants :
a) 2,4,4-triméthylpentan-2-ol b) 3-propylcyclohexan-1-ol
c) pentan-2,3-diol d) o-bromophénol
e) tricyclopropylméthanol f) 3,7-diméthyloct-6-èn-1-ol (ou citronellol)
4. Classer les composés suivants par ordre croissant de leur solubilité dans l’eau et en
donner brièvement les raisons :
Pentan-1-ol, pentan-1,5- diol, CH2OH(CHOH)3CH2OH
5. Donnez le produit de l’oxydation ménagée de l’alcool suivant:
Cette réaction constitue une étape de
la synthèse du longifolène, une molé-
cule produite par plusieurs variétés de
conifères.
6. Le dichromate de potassium en milieu acide (H2SO4) oxyde le propan-2-ol en
propanone.
a) Ecrire les demi-équations d’oxydo-réduction, l’équation oxred équilibrée complète,
puis l’équation équilibrée de cette réaction.
b) Quel volume d’une solution acidifiée de dichromate de potassium 0,1 M faut-il pour
oxyder 1 g de propan-2-ol ?
7. Le pentan-1-ol est oxydé en milieu acide par l’oxyde de manganèse(IV) solide dont le
couple Ox/Red est le suivant : MnO2(s) / Mn2+
a) Ecrivez la réaction d’oxydation et la réaction de réduction ainsi que la réaction
équilibrée d’oxydoréduction ionique
b) Sachant que l’on a utilisé de l’acide sulfurique pour oxyder le pentan-1-ol, écrivez
l’équation d’oxydoréduction équilibrée complète de cette réaction.
OH
Cl
Cl
OH
OH
OH
Cl
Cl
a)
OH
OH
OH

3OS
Les composés oxygénés - exercices supplémentaires avec la correction 2
Les aldéhyde, les cétones, les acides carboxyliques et les esters
8. Nommer chacun des composés suivants :
a) b) c)
d) e) f)
9. Ecrire les formules développées des composés suivants :
a) pentan-2,4-dione b) 1-phénylbutan-2-one c) 2,2-dibromohexanal
d) acide p-toluïque e) acide 3-méthylpentanoïque
10. L’odeur de fromage est due à une molécule linéaire de masse molaire M = 86 (g/mol)
comportant deux fonctions cétone.
a) Proposer une formule (semi-)développée pour cette molécule.
b) Suggérer un nom pour cette molécule.
11. Lorsque l’éthanal est oxydé en milieu acide par le permanganate de potassium, on
obtient, entre autre, le ion manganèse (II) et de l’eau.
Ecrire
- l’équation de la réaction d’oxydation.
- l’équation de la réaction deréduction.
- l’équation oxred équilibrée complète.
- l’équation équilibrée de cette réaction.
12. A partir de la formule brute C5H8O2,
a) Former a) un acide carboxylique b) un ester;
c) un aldéhyde ; d) une polycétone
b) Nommer les composés formée sous a).
13. Nommer les composés suivants :
OH
Cl
Cl
a)
C
H
COH
O
b)
CH3CH=CHCCH3
O
c)
OH
O
OH
O
d) (CH3)2CHCH2CHO
e) O
O
f)

3OS
Les composés oxygénés - exercices supplémentaires avec la correction 3
14. Ecrire les formules développées des composés suivants :
a) p-tolualdéhyde b) 5-isopropyl-2-méthylcyclohex-2-ènone
15. Complétez et équilibrez les réactions chimiques suivantes en donnant la formule
développée et le nom du produit obtenu.
H2SO4
a) acide pentanoïque + 3-méthylbutan-1-ol →
b) 2-phénylbutanal + KMnO4 + H2SO4 →
H2SO4
c) CH3-CH=CH-CH3 + H2O →
Corrections
1. primaire :
OH
OH
; secondaire :
OH
tertiaire :
OH
2. a) o,p-dichlorophénol ou 2,4-dichlorophénol b) 4,4-diméthylpentan-1,3-diol
c) 1-éthylcyclohex-3-èn-1-ol d) 3-phénylprop-2-èn-1-ol,
e) 2-isobutyl-5-méthylcyclohexan-1-ol f) 4,5-dichlorooct-2,4,6-trièn-2-ol
3. a)
OH
b)
OH
c)
OH
OH
d)
OH
Br
e)
OH
f)
OH
4. Solubilité : Pentan-1-ol (1 alcool) < pentan-1,5- diol (2 alcools) <
CH2OH(CHOH)3CH2OH (5 alcools).
La solubilité des alcools dans l’eau dépend de la possibilité pour l’alcool de faire des
ponts hydrogène avec l’eau. Plus il y a de fonctions alcool, plus il y a aura de ponts
hydrogène entre l’alcool et l’eau et plus l’alcool sera soluble.
5.
O

3OS
Les composés oxygénés - exercices supplémentaires avec la correction 4
6. a) (CH3)2CHOH + K2Cr2O7 + H2SO4 (CH3)2CO + Cr2(SO4)3 + H2O + K2SO4
Oxydation: C0 C+2 + 2e │x3
Réduction: Cr+6 + 3e Cr+3 │x2
Oxred complète: 3C0 + 2Cr+6 3C+2 + 2Cr+3
Eq. Equilibrée: 3 (CH3)2CHOH + K2Cr2O7 + 4 H2SO4
3 (CH3)2CO + Cr2(SO4)3 + 7 H2O + K2SO4
b) Mpropan-2-ol= 60 g/mol ;
Moles d’alcool= 1/60= 1,67 2
10−
•mol ;
Moles dichromate : 1,67 2
10−
•/3 = 5.57 3
10−
•mol ;
Vdichromate =5.57 3
10−
•/0.1= 5.57 2
10−
•l = 55,7 ml
7. a) CH3(CH2)3CH2OH + MnO2 + H+ CH3(CH2)3CHO + Mn2+ + H2O
Oxydation: C-1 C+1 + 2e
Réduction: Mn+4 + 2e Mn+2
Bilan. C-1 + Mn+4 C+1 + Mn+2
Eq. Equilibrée : CH3(CH2)3CH2OH + MnO2 + 2 H+ CH3(CH2)3CHO + Mn2+ + 2 H2O
b) CH3(CH2)3CH2OH + MnO2 + H2SO4 CH3(CH2)3CHO + MnSO4 + 2 H2O
8. a) pentan-3-one b) cyclopentanone c) 2-méthylpropanal
d) acide 2,2-difluoropropanoïque e) propanoate de calcium f)but-3-ènal
9. a)
b) c)
d) e)
10. Formule brute générale d’un composé avec deux fonctions cétone : CnH2n-2O2
M(CnH2n-2O2) = 86 (g/mol) M(O2) = 32 (g/mol) M(CnH2n-2)= 86 – 32 = 54 (g/mol)
n·12 + (2n-2)·1 = 54 ⇒ 14n =56 ⇒ n = 56/14 = 4
Formule brute : C4H6O2 ; Nom :butandione
Formule développée :
O
C
H2
CH3
O
CH3OCH3
C
H
2
C
H2
C
H
2C
H
O
Br
Br
OH
OOH
O
CH3
O
O
CH3

3OS
Les composés oxygénés - exercices supplémentaires avec la correction 5
11. 5 CH3CHO + 2 KMnO4 + 6 H+ → 5 CH3COOH + 2 Mn2+ + 2 K+ + 3 H2O
Oxydation: C+1 C+3 + 2e- │x 5
Réduction: Mn+7 + 5e- Mn+2│x 2
Oxred complète: 5C+1+ 2Mn+7 5C+3+ 2Mn+2
Equation équilibrée de la reaction (avec les ions Cl-)
5 CH3CHO + 2 KMnO4 + 6 HCl 5 CH3COOH + 2 MnCl2 + 2 KCl + 3 H2O
12. a)
O
OH
b)
O
O
c)
O
H
OH
d)
O O
;
a) acide pent-4-ènoïque b) prop-2-ènoate d’éthyle
c) 4-hydroxypent-2-ènal d) 2,4-pentandione
13. a) o,p-dichlorophénol ou 2,4-dichlorophénol
b) acide 2,2-dicyclobutyléthanoïque ou acide 2,2-dicyclobutylacétique
c) pent-3-èn-2-one d) acide heptandioïque
e) 3-méthylbutanal f) 2-méthylpropanoate de (3-éthyl)pentyle
14. a)
O
H
b)
15. a)
OH
O
OH
H2SO4
+
O
O
pentanoate de (3-méthyl)butyle
b)
O
H
KMnO4H2SO4
++
O
OH
K2SO4MnSO4
++
H2O
+
552
233
acide 2-phénylbutanoïque
c)
OH
+
H2O
Butan-2-ol
1
/
5
100%