Glucides : Composition, Classification et Isomérie

C. LARCHER 1.2.1- Oses – Page 1 / 19 –
CHAPITRE 1.2 : LES GLUCIDES
Groupe de composés aux fonctions très importantes :
• Rôle énergétique : glucose (forme d’énergie directement utilisable par les cellules), amidon (forme de
stockage du glucose chez les végétaux), glycogène (forme de stockage du glucose chez les animaux) …
• Rôle structural : cellulose (constituant principal de la paroi des cellules végétales, polymère de
glucose), chitine (polymère de N-acétylglucosamine, carapace des arthropodes et paroi des mycètes)…
• Signaux de reconnaissance et de communication entre les cellules : glycoprotéines membranaires
(exemple des antigènes des groupes sanguins A, B, O).
1. Composition élémentaire
C, H, O
2. Fonctions chimiques
Groupement carbonyle : fonctions aldéhyde ou cétone
Groupement hydroxyle : fonction alcool
3. Classification des glucides
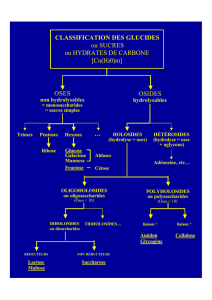
Classification des glucides
Glucides
Non hydrolysables = oses = molécules de base
Hydrolysables = osides
Condensation d’un ou de plusieurs oses
= holosides
Condensation d’oses et de constituants non
glucidiques
= hétérosides

C. LARCHER 1.2.1- Oses – Page 2 / 19 –
Également appelés monosaccharides ou sucres simples
Non hydrolysables
Molécules comportant de 3 à 7 atomes de carbone
Formule brute : CnH2nOn : Cn(H2O)n
Cette formule brute explique le terme utilisé en anglais d’hydrate de carbone.
Polyol qui porte au moins 2 fonctions alcools dont l’une au moins est une fonction alcool primaire, et une
groupement carbonyle réductrice, soit :
• aldéhyde (-CHO) dans ce cas l’ose est un aldose.
• cétone (>C=O) dans ce cas l’ose est un cétose.
L’ose le plus répandu est un aldohexose en C6 : le glucose.
Formule brute : C6H12O6
1. Formule développée et isomérie
1.1. Isomères de constitution (de fonction)1
Des isomères sont des molécules de même formule brute mais de formules développées différentes.
Des isomères de constitution comportent des enchaînements d’atomes différents.
Des isomères de fonction possèdent des groupes fonctionnels différents, donc des propriétés
physiques et chimiques différentes.
Les oses les plus simples ont trois atomes de carbone : glycéraldéhyde et dihydroxyacétone
• Aldose : glucide avec fonction aldéhydique en bout de chaîne (C1)
• Cétose : glucide avec fonction cétone à l’intérieur de la chaîne (C2).
D(+)-glycéraldéhyde
L(-)-glycéraldéhyde
Dihydroxyacétone
Figure 1 : distinction entre un aldose et un cétose (exemple avec C3)
On remarque que le C2 du glycéraldéhyde porte 4 substituants différents ⇒ C asymétrique ⇒
propriétés optiques (pouvoir rotatoire) : existence de 2 isomères optiques images l’un de l’autre
dans un miroir : on parle d’énantiomères (D-glycéraldéhyde et L-glycéraldéhyde).
1 http://fr.wikipedia.org/wiki/Isomérie#Diast.C3.A9r.C3.A9oisom.C3.A9rie
C
OH
CHOH
CH2OH
CH2OH
C
CH2OH
O
C
OH
CH2OH
OHH
C
OH
CH2OH
HHO

C. LARCHER 1.2.1- Oses – Page 3 / 19 –
1.2. Stéréoisomères
Le glucose a pour formule développée :
HOH2C – C*HOH – C*HOH – C*HOH – C*HOH – CH = O
Il possède 4 carbones asymétriques (C*). Il existe donc 24 = 16 stéréoisomères différents.
Les stéréoisomères sont des isomères de configuration, c’est-à-dire des molécules de constitution
identique mais dont l’organisation spatiale des atomes est différente.
Pour visualiser les stéréoisomères, on utilise la représentation ou projection de Fischer.
1.2.1. Représentation de Cram
• C dans le plan de la feuille.
• Liaison en pointillés : liaison dirigée vers l’arrière.
• Liaison en trait épais : liaison dirigée vers l’avant.
1.2.2. Représentation de Fischer
La projection de Fischer est surtout utilisée pour représenter les sucres et les acides aminés.
Elle fut inventée par Hermann Emil Fischer.
Passage de la représentation de Cram à la représentation de Fischer :
• la chaîne carbonée est orientée avec son groupement le plus oxydé dirigé vers le haut
• les traits verticaux symbolisent des liaisons dirigées vers l’arrière
• les traits horizontaux symbolisent des liaisons dirigées vers l’avant
On ne représente pas les atomes de carbone, ils sont situés à l’intersection des segments
horizontaux et du trait vertical. La représentation de Fischer est souvent allégée en ne marquant la
position des groupements OH que par des tirets.
Par convention, le D-glycéraldéhyde est l’énantiomère qui a le groupement OH positionné à
droite dans la représentation de Fischer.
Cette représentation permet de différencier facilement les énantiomères chiraux2 L ou D.
Figure 2 : représentations de Cram et de Fischer du D-glucose
On classe les isomères de configuration en trois grands groupes : les énantiomères, les
diastéréoisomères et les épimères.
1.2.3. Diversité des stéréoisomères
a. Enantiomères
Un énantiomère est un isomère de configuration non superposable à son homologue
après symétrie dans un miroir.
Tous les oses possèdent un pouvoir rotatoire3 du fait de la présence d’un carbone
asymétrique, les oses sont dits chiraux.
2 Molécule chirale : molécule qui ne peut pas se superposer à son image dans un miroir
3 Pouvoir rotatoire : se dit du pouvoir qu'ont les substances asymétriques de faire tourner le plan de polarisation de la lumière.

C. LARCHER 1.2.1- Oses – Page 4 / 19 –
Deux énantiomères (antipodes optiques) ont les mêmes propriétés physiques et
chimiques à l’exception d’une seule : leur pouvoir rotatoire opposé (voir paragraphe 3.1.1 :
propriétés optiques).
Dans la forme D, le groupement alcool (–OH) porté par le carbone n − 1 est à droite
(en représentation de Fischer) comme le (+)-glycéraldéhyde.
Dans la forme L, le groupement alcool (–OH) porté par le carbone n − 1 est à gauche
(en représentation de Fischer) comme le (–)-glycéraldéhyde.
La figure 4 représente les deux énantiomères du glucose, la forme D-glucose est la
forme naturelle. Les oses de la série D sont naturels.
Figure 3 : énantiomères du glucose
Un mélange équimolaire de 2 énantiomères est appelé mélange racémique. Il se caractérise
par l’absence d’un pouvoir rotatoire car les effets d’un des énantiomères sur la déviation du plan de
la lumière polarisée sont annulés par ceux du second (voir paragraphe 1.2.4).
b. Diastéréoisomères
Les diastéréoisomères sont les stéréoisomères qui ne sont pas des énantiomères.
c. Epimères
Deux épimères ne diffèrent entre eux que par la configuration absolue d’un seul carbone
asymétrique, comme par exemple entre le D-mannose et le D-glucose ou encore entre le
D-glucose et le D-galactose.
1.2.4. Pouvoir rotatoire
Voir TP sur la polarimétrie
En solution, les formes énantiomères d’une molécule portant un carbone asymétrique
présentent des propriétés optiques différentes. Elles sont douées d’une activité optique : chacune
d’entre elles dévie de manière spécifique le plan de polarisation d’une onde monochromatique
polarisée. Le plan de polarisation est dévié d’un angle égal en valeur absolue mais de sens inverse.
Cette propriété est caractérisée par le pouvoir rotatoire spécifique qui répond à la loi de Biot :
€
α
=
α
[ ]
T,
λ
×c
α : angle de rotation observée en degré (°).
[α]T, λ : pouvoir rotatoire spécifique de la substance, constant pour une température et une
longueur d’onde données (en °.g-1.cm2, unité souvent non mentionnée car rébarbative, à convertir
en °.g-1.dm2 pour le calcul).
: longueur de la cellule contenant la substance, traversée par la lumière (en dm)
c : concentration massique de la substance (en g.mL-1)

C. LARCHER 1.2.1- Oses – Page 5 / 19 –
L’un des énantiomères du glycéraldéhyde à la concentration de 1 g.mL-1 dévie vers la droite
le plan de polarisation d’un faisceau monochromatique (λ = 570 nm) de 14° pour un chemin
optique de 10 dm à une température de 20°C. Cet énantiomère est une substance dextrogyre, il est
noté (+). L’autre énantiomère est dit lévogyre (–). Ces deux énantiomères sont aussi appelés
isomères optiques. Un mélange équimolaire de deux énantiomères est optiquement inactif : il est dit
racémique.
D-glucose
L-glucose
ENANTIOMÈRES
Epimère (en C2) du D-glucose
Epimère (en C4) du D-glucose
D-mannose
D-galactose
DIASTÉRÉOISOMÈRES
Figure 4 : illustration de la notion d’énantiomères, d’épimères et de diastéréoisomères
Voir planche 2 chapitre 1.2.1 : filiation des oses
Remarque : en général, le suffixe des aldoses est « -ose » alors que celui des cétoses est « -ulose » (sauf
exceptions : fructose, sorbose,…).
OH
CH2OH
OH
CH2OH
OH
CH2OH
OH
CH2OH
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%