Cours - PhyZik

D2
Composés organiques oxygénés
Les alcanes et les alcènes sont des molécules organiques simples. L’ajout d’atomes d’oxygène permet d’obtenir
d’autres familles de composés organiques : les alcools, les aldéhydes, les cétones et les acides carboxyliques dont
nous allons étudier quelques propriétés.
I - Représentation des molécules
1) Formule de Lewis Activité Lewis + modèles moléculaires
La représentation de Lewis d'une molécule fait apparaître tous les atomes de la molécule ainsi que tous les doublets
liants et non liants le cas échéant.
Les doublets non liants sont les paires d'électrons qui ne servent pas de liaisons entre deux atomes.
Dans la représentation de Lewis, les règles du duet et de l’octet doivent être respectées.
Méthode :
1. Écrire la configuration électronique de chacun des atomes constituant la molécule.
2. Déterminer le nombre d'électrons périphériques de chaque atome.
3. En déduire le nombre de liaisons covalentes que peut établir chaque atome.
4. Nombre de doublets non liants : c’est le nombre de doublets respectant la règle du duet (1 doublet ) ou la
règle de l'octet ( 4 doublets ) moins le nombre de liaisons covalentes.
5. Donner la formule de Lewis de la molécule en représentant les doublets liants en rouge et les doublets non
liants en bleu.
Exemple: on veut représenter le modèle de Lewis de la molécule d’eau H2O (H: Z=1; O: Z=16.)
H
O
Configuration électronique
(K)1
(K)2(L)8(M)6
Nombre d’électrons périphériques
1
6
Nombre de liaisons covalentes
2-1 = 1
8-6 = 2
Nombre de doublets non liants
1-1= 0
4-2 = 2
2) Géométrie des molécules
La théorie de la répulsion minimale des doublets permet de rendre compte de la géométrie des molécules.
Exemples : Dans les exemples suivants (E) représente un doublet non liant. Les structures étudiées ici sont toutes
tétraédriques.
Les doublets sont en rouge et en bleu. Les lignes grises délimitent le volume occupé par la molécule mais n'ont pas
d'existence réelle.
La molécule de méthane a une forme géométrique tétraédrique.
La molécule d'ammoniac a une forme géométrique pyramidale
La molécule d'eau a une forme géométrique plane coudée.
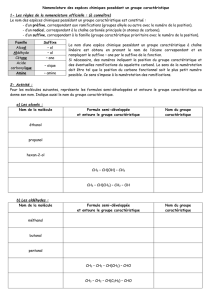
II – Les alcools
1) Nomenclature
Molécules présentant un groupe d’atomes -OH dit hydroxyle sur une chaine carbonée.
Numéroter la chaine carbonée comportant le groupe hydroxyle de telle sorte que l’atome de carbone qui porte
ce groupe ai le plus petit numéro.
Donner une terminaison -ol précédée du numéro du carbone portant le groupe hydroxyle.

Identifier les groupes alkyles éventuels et les nommer.
Ex :
Butan-1-ol
2-méthylbutan-1-ol
3-éthyl-3-méthylpentan-2-ol
2) Propriétés physiques
a) Température de changement d’état
Doc 1 : Températures d’ébullition en °C pour différents alcanes linéaires et alcools primaires
Nombre de carbones
1
2
3
4
5
6
7
8
9
alcanes
-164
-88,5
-44,5
0,6
36,2
69
98,5
126
150,5
alcools
64,7
78,4
97
117
138
156
174
194
231,5
L’intensité des interactions de Van der Waals et donc les températures d’ébullition et de fusion augmentent avec
la longueur de la chaine carbonée.
Les alcools ont des températures de changement d’état supérieures grâce à l’existence de liaisons hydrogène
dues aux groupes hydroxyles.
Ex :
Doc 2 : Températures d’ébullition des isomères de formule brute .
Pentane : 36°C
2-méthylbutane : 28°C
2,2-diméthylpropane : 9,5°C
CH3CH
CH3
CH2OH
CH
CH3
CH
CH2
CH3
CH2
CH3
CH3
OH
-200
-150
-100
-50
0
50
100
150
200
250
300
0 2 4 6 8 10
alcanes
alcools
CH3CH2CH2CH2CH3
CH3CH CH2CH3
CH3
CH3CCH3
CH3
CH3
CH3CH2CH2OH
3-éthyl-4-méthylpentan-1-ol
OH

O
H
H
HO
CH3
HO
H
HO
CH3
CO
R
H
CH3CH
CH3
CH2C
O
CH3
Les températures de changement d’état des alcanes sont d’autant plus basses que ceux-ci sont ramifiés.
b) Miscibilité des alcools avec l’eau
Exp : Des alcools avec des chaines carbonées de plus en plus longues sont mélangés avec de l’eau.
Les mélanges obtenus sont homogènes mais avec une solubilité qui diminue : pour l’hexan-1-ol , s = 6 g.L-1
La miscibilité des alcools avec l’eau est due au groupe hydroxyle –OH qui
établit des liaisons hydrogène avec les molécules d’eau.
Mais la miscibilité des alcools avec l’eau diminue lorsque la longueur de la
chaine carbonée augmente.
Application : Distillation fractionnée
Elle permet de séparer les constituants d’un mélange de liquides miscibles
possédant des températures d’ébullition différentes.
Acti – Distillation fractionnée
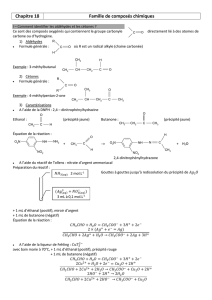
III – Comment identifier les aldéhydes et les cétones ?
Séance de TP-cours
Ce sont des composés oxygénés qui contiennent le groupe carbonyle directement lié à des atomes de
carbone ou d’hydrogène.
1) Aldéhydes
Formule générale : où R est un radical alkyle (chaine carbonée)
Exemple : 3-méthylbutanal
2) Cétones
Formule générale :
Exemple : 4-méthylpentan-2-one
3) Caractérisations
A l’aide de la DNPH : 2,4 – dinitrophénylhydrazine
Ethanal : (précipité jaune) Butanone : (précipité jaune)
Équation de la réaction :
+ + H2O
2,4-dinitrophénylhydrazone
A l’aide du réactif de Tollens : nitrate d’argent ammoniacal
Préparation du réactif :
Gouttes à gouttes jusqu’à redissolution du précipité de
+ 1 mL d’éthanal (positif), miroir d’argent
CO
CH3CH
CH3
CH2C
H
O
CO
R
R'
CH3C
O
H
CH3CH2C
O
CH3
O2N
NO2
NH NH2
CH3C
O
H
O2N
NO2
NH NC
H
CH3
2 mol.L-1
3 mL à 0,1 mol.L-1

C
O
OH
C
O
OH
HO
H
O
H
H
+ 1 mL de butanone (négatif)
Équation de la réaction :
A l’aide de la liqueur de Fehling :
avec bain marie à 70°C, + 1 mL d’éthanal (positif), précipité rouge
+ 1 mL de butanone (négatif)
IV – Qu’est-ce qu’un acide carboxylique ?
1) Nomenclature
Un acide carboxylique est un composé oxygéné qui contient le groupe carboxyle :
Exemples : acide 3-méthylbutanoïque :
Acide benzoïque :
2) Propriétés
Le BBT qui est in indicateur coloré acido-basique nous permet de confirmer le caractère acide.
Solubilité :
Exemple : L’acide benzoïque est moins soluble dans l’eau que l’acide éthanoïque.
Les molécules d’acide carboxylique qui possèdent 5 atomes de carbone ou moins sont très solubles dans l’eau.
Il se forme des liaisons hydrogène avec l’eau mais elles sont moins fortes avec une longue chaine carbonées :
C OH
O
C OH
O
CH2
CH
CH3
CH3
BBT
Acide éthanoïque
(jaune)
Acide chlorhydrique
(jaune)
soude (bleu)

Famille de composés chimiques
Par poste :
DNPH + compte goutte dans un tube à essais
Solution nitrate d’argent à 0,1 M (0,5 L pour les deux
groupes)
Solution d’ammoniaque à 2 M sous la hotte avec compte
gouttes + bécher
Rampe de 6 tubes à essais
Bécher 50 mL + pipette
Liqueur de Fehling
BBT dans compte gouttes
Soude dans compte gouttes
Acide chlorhydrique dans compte gouttes
Au bureau :
Butanone
Ethanal
Acide éthanoïque à 0,1 M
Bain marie pour les tubes à essais à 70°C
Famille de composés chimiques
Par poste :
DNPH + compte goutte dans un tube à essais
Solution nitrate d’argent à 0,1 M (0,5 L pour les deux
groupes)
Solution d’ammoniaque à 2 M sous la hotte avec compte
gouttes + bécher
Rampe de 6 tubes à essais
Bécher 50 mL + pipette
Liqueur de Fehling
BBT dans compte gouttes
Soude dans compte gouttes
Acide chlorhydrique dans compte gouttes
Au bureau :
Butanone
Ethanal
Acide éthanoïque à 0,1 M
Bain marie pour les tubes à essais à 70°C
Famille de composés chimiques
Par poste :
DNPH + compte goutte dans un tube à essais
Solution nitrate d’argent à 0,1 M (0,5 L pour les deux
groupes)
Solution d’ammoniaque à 2 M sous la hotte avec compte
gouttes + bécher
Rampe de 6 tubes à essais
Bécher 50 mL + pipette
Liqueur de Fehling
BBT dans compte gouttes
Soude dans compte gouttes
Acide chlorhydrique dans compte gouttes
Au bureau :
Butanone
Ethanal
Acide éthanoïque à 0,1 M
Bain marie pour les tubes à essais à 70°C
1
/
5
100%