Etude de la réaction d`un acide sur l`eau

18/04/17 582699877 1/4
CHIMIE
ETUDE DE LA REACTION D'UN ACIDE SUR L'EAU
Chap.4
But du TP
Mise en évidence expérimentale sur une transformation chimique donnée, d’un avancement final différent de
l’avancement maximal. Symbolisme d’écriture de la réaction par le symbole « = ».
Etat d’équilibre d’un système chimique.
Taux d’avancement final d’une réaction = xfinal
xmax. est généralement exprimé en %.
Compétences exigibles
Utiliser la relation pH = - log([H3O+]) ou [H3O+] = 10-pH.
Connaissant la valeur de la concentration et du pH d’une solution d’acide, calculer l’avancement final de la
réaction de cet acide sur l’eau et le comparer à l’avancement maximal.
Connaître la définition du taux d’avancement final et le déterminer à partir d’une mesure.
Objectifs expérimentaux
Savoir étalonner un pH-mètre.
Etre capable de mesurer le pH d’une solution aqueuse avec un pH-mètre.
Rappels
Lors de l’étude des réactions de dosages acido-basiques, en solution, les ions chlorure et les ions sodium ne
réagissent pas avec l’eau (simple hydratation : les ions Cl-(aq) et Na+(aq) sont indifférents ou spectateurs).
Etalonnage et utilisation du pH-mètre
L’étalonnage, qui a déjà été réalisé, se déroule en 2 étapes :
Réglage d’un 1er pH à 7,0 avec une 1ère solution dont le pH est connu (solution tampon).
Réglage d’un 2nd pH (souvent à 4,0) avec une 2nde solution dont le pH est connu (solution tampon).
Utilisation du pH-mètre
Certains pH-mètres disposent d’un bouton de réglage de température ; si c’est le cas, il faut régler l’indication
de la température avant les immersions dans les solutions de pH connus
Après chaque immersion de l’électrode combinée du pH-mètre dans une solution, il convient de la rincer avec
une pissette d’eau distillée (au-dessus d’un verre à pied) et de la sécher avec du papier.
I. Etude de la réaction du chlorure d’hydrogène sur l’eau
1. Etude expérimentale
Etudier un mélange obtenu en introduisant 1,0 mL de solution aqueuse d’acide molaire dans une fiole jaugée de
100,0 mL et compléter à 100 mL avec de l’eau distillée revient à étudier directement une solution aqueuse
centimolaire d’acide Cac = 1,0.10-2 mol.L-1. (On admet que les transformations chimiques entre les acides, les
bases et l’eau sont instantanées).
Réaliser, avec beaucoup de précision, 100,0 mL d’une solution d’acide chlorhydrique centimolaire à partir de la
solution mère molaire.
1.1. Verser dans un pot V = 100 mL de solution aqueuse d’acide chlorhydrique centimolaire et mesurer son pH.
Noter le résultat : pH1 = ....
Conserver votre solution d’acide chlorhydrique pour la suite du TP.
2. Etude théorique de l’avancement de la réaction du chlorure d’hydrogène avec l’eau
L’équation de la réaction traduisant la transformation chimique se déroulant entre le chlorure d’hydrogène et
l’eau peut s’écrire : HCl(g) + H2O H3O+ + Cl-(aq)
2.1. Calculer la quantité de matière d’acide initialement présente dans 100 mL de solution aqueuse d’acide
chlorhydrique de concentration Cac = 1,0.10-2 mol.L-1.
2.2. Comme l’eau est toujours en excès en solution aqueuse, calculer l’avancement maximal xmax de la réaction
de l’acide chlorhydrique sur l’eau.
2.3. A partir du résultat de pH1, calculer la quantité de matière à l’état final d’ions oxonium nf(H3O+)1 présents
dans V = 100 mL de la solution étudiée.
2.4. Comparer ni(ac) et nf(H3O+)1.
2.5. Calculer l’avancement final xfinal de la transformation chimique et le comparer avec xmax.
2.6. Calculer le taux d’avancement final de la transformation chimique ayant eu lieu entre le chlorure
d’hydrogène et l’eau.

18/04/17 582699877 2/4
II. Etude de la réaction de l’acide éthanoïque (ou acide acétique) sur l’eau
1. Etude expérimentale
Introduire dans un pot, à l’aide d’une éprouvette graduée, 100 mL de solution d’acide éthanoïque centimolaire.
1.1. Mesurer le pH de la solution. Noter le résultat : pH2 = ..…… .
2. Etude théorique de l’avancement de la réaction de l’acide éthanoïque avec l’eau
L’équation de la réaction traduisant la transformation chimique se déroulant entre l’acide éthanoïque et l’eau
peut s’écrire : CH3-COOH(aq) + H2O H3O+ + CH3-COO-(aq)
Pour simplifier l’écriture, le groupement « CH3COO » sera écrit « A » soit :
AH(aq) + H2O H3O+ + A-(aq)
2.1. Calculer la quantité de matière d’acide initialement présente dans 100 mL de solution aqueuse d’acide
éthanoïque de concentration Cac = 1,0.10-2 mol.L-1
2.2. Comme l’eau est toujours en excès en solution aqueuse, calculer l’avancement maximal xmax de la réaction
de l’acide éthanoïque sur l’eau.
2.3. A partir de ce résultat, calculer la quantité de matière d’ions oxonium à l’état final nf(H3O+)2 présents dans V
= 100 mL de la solution étudiée.
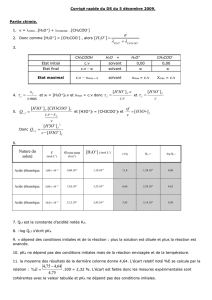
2.4. Compléter ensuite le tableau descriptif de l’évolution du système.
Equation de la réaction
AH(aq) + H2O H3O+ + A-(aq)
initial
0
intermédiaire
x
final
xfinal = ............
maximal
xmax = ............
2.5. Comparer l’avancement final xfinal et l’avancement maximal xmax.
L’état final est atteint alors que l’acide éthanoïque (qui est le réactif limitant) n’a pas entièrement disparu ; le
pH n’évoluant pas au cours du temps, ce n’est donc pas une question de cinétique, l’évolution a atteint son
terme.
2.6. Calculer le taux d’avancement final de la transformation chimique ayant eu lieu entre l’acide éthanoïque et
l’eau.
III. Etude de la réaction de l’ion éthanoate (ou acétate) sur l’ion oxonium
L’éthanoate de sodium est un solide blanc de formule CH3COONa(s) ; ce composé est généralement hydraté, on le
trouve souvent sous forme trihydratée CH3COONa, 3H2O de masse molaire 136 g.mol-1. Par dissolution dans l’eau,
il y a dispersion des ions : CH3-COONa(s) Na+(aq) + CH3-COO-(aq)
soit (Na+(aq) + A-(aq))
1. Etude expérimentale
Préparer 1,0 mmol d’acétate de sodium soit 0,136 g d’acétate de sodium trihydraté CH3COONa, 3H2O.
Introduire cette poudre dans 100 mL de solution centimolaire d’acide chlorhydrique ce qui correspond (avant le
mélange) à 1,0 mmol d’ions oxonium (cf. § I). On peut considérer que le volume de la solution n’a pas varié.
1.1. Mesurer le pH de cette solution. Noter le résultat : pH3 = .... .
2. Etude théorique de l’avancement de la réaction de l’acétate de sodium sur l’ion oxonium.
Les ions Na+(aq) sont sans action sur l’eau, ils n’apparaissent pas dans l’écriture de l’équation de la réaction
traduisant la transformation chimique se déroulant entre l’acétate de sodium et l’ion oxonium ; celle-ci peut
donc s’écrire : H3O+ + CH3-COO-(aq) CH3-COOH(aq) + H2O ou plus simplement
H3O+ + A-(aq) AH(aq) + H2O
La présence initiale de 10-3 mol d’éthanoate de sodium permet d’écrire ni(A-(aq)) = 1,0 mmol.
2.1. Déterminer l’avancement maximal xmax qui serait atteint s’il y avait épuisement des réactifs (remarquer que
les quantités de matière initialement présentes sont toutes deux égales à 1,0 mmol ).
2.2. A partir de la valeur du pH3, calculer nf(H3O+)3.

18/04/17 582699877 3/4
2.3. Compléter le tableau descriptif de l’évolution du système qui permet de déterminer xfinal.
Equation de la réaction
H3O+ + A-(aq) AH(aq) + H2O
initial
0
intermédiaire
x
final
xfinal = ............
maximal
xmax = ............
2.4. Calculer alors le taux d’avancement final .
IV. Etude du taux d’avancement final d’un système chimique dans l’état d’équilibre
On considère la transformation chimique qui a abouti à l’état d’équilibre rencontré ci-dessus, c’est à dire :
AH(aq) + H2O = H3O+ + A-(aq)
1. Influence de la concentration initiale en acide de la solution
A 100 mL de solution d’acide centimolaire d’acide éthanoïque, ajouter 100 mL d’eau distillée et mesurer le pH.
(Travailler sur agitateur magnétique pour homogénéiser la solution).
1.1. Consigner les résultats dans un tableau en remarquant que :
La quantité de matière d’acide reste égale à 1,0 mmol.
Que les résultats de la 1ère ligne ont déjà été déterminés au §II.
V = Volume total de la
solution (en mL)
pH
xfinal (mol)
xmax (mmol)
taux d’avancement final = xfinal
xmax
100
pH2 = ............
1,0
200
pH4 = ............
1,0
1.2. Conclure en donnant le sens de l’évolution du système chimique quand on le dilue.
2. Influence de la quantité d’ions acétate introduite
A 100 mL de solution centimolaire d’acide éthanoïque, ajouter une pointe de spatule d’acétate de sodium, (il
n’y a pas de variation notable de volume) puis mesurer le pH. (Travailler sur agitateur magnétique pour
homogénéiser la solution).
2.1. Consigner les résultats dans un tableau en remarquant que :
La quantité de matière d’acide reste toujours égale à 1,0 mmol.
Que le volume de la solution reste égal à 100 mL.
Que les résultats de la 1ère ligne ont déjà été déterminés au § II.
ni(A-(aq)) (mmol)
pH
xfinal (mol)
xmax (mmol)
taux d’avancement final = xfinal
xmax
0
pH2 = ............
1,0
0
pH5² = ............
1,0
2.2. Conclure en donnant le sens de l’évolution du système chimique quand on y ajoute l’un des produits formés.

18/04/17 582699877 4/4
V. Notion d’état d’équilibre d’un système chimique
Au § II, il a été écrit : AH(aq) + H2O H3O+ + A-(aq) ; sens « direct ».
Au § III, il a été écrit : H3O+ + A-(aq) AH(aq) + H2O ; sens « inverse ».
Ces 2 équations de réaction correspondent à une transformation chimique ayant deux évolutions possibles.
Lorsque l’une ou l’autre de ces évolutions a atteint son avancement final :
Il y a dans le milieu réactionnel les 4 espèces H3O+ , A-(aq) , AH(aq) et H2O.
A l’état microscopique, ces espèces réagissent toujours entre elles aussi bien dans le sens « direct » que dans le
sens « inverse », mais la vitesse de formation d’une espèce est égale à la vitesse de disparition de cette même
espèce.
A l’état macroscopique, le système semble ne plus évoluer ; il semble figé. Les quantités de matière (et les
concentrations) des réactifs et des produits sont stationnaires.
On dit que les 4 espèces sont en « ETAT D’EQUILIBRE ». On parle d’équilibre dynamique parce que deux
réactions inverses et simultanées s’effectuent à la même vitesse.
Dans l’écriture de l’équation de la réaction de la transformation chimique qui aboutit à un état d’équilibre, la
flèche habituelle est remplacée par le signe « = ».
Ce signe « = » indique simplement le bilan de matière (et éventuellement de charge) sans préjuger du sens dans
lequel s’effectue la transformation.
On écrit donc pour la transformation étudiée : AH(aq) + H2O = H3O+ + A-(aq) .
1
/
4
100%