Tp chimie mesures de pH des acides et des bases 1 I. mesures du

Tp chimie mesures de pH des acides et des bases
!
!
"!
I. mesures du pH par différentes méthodes
!
!"#$%&'()*)+),&)-.-/&0)-1)
#$%&'!()!*+*,%-!,./,/0!1$()!,)1,2+'%(-!2343-0!(),5%-&%4!6!
7-82%!9!4$02:%44%!1%!'%,)'%&!1%!4+!/3;'%<!estimer'le'pH'de'ces'deux'solutions.'
20"("#",&)+!=!4$+,1%!1$()!+>,'+'%(-!%)!5%--%!*-3*-%<!*-0+4+/4%.%)'!'-%.*0!1+)&!4+!&34(',3)<!'3(2:%-!4%!
*+*,%-!*?!10*3&0!&(-!4+!23(*%44%!%)!5%--%!
@!A%!B+.+,&!*43)>%-!4%!*+*,%-!*?!1+)&!4+!&34(',3)!C6!!
!
!
!"#$%&'()3)+),&4)/'5/#.(&$04)#","064)5&)-1))
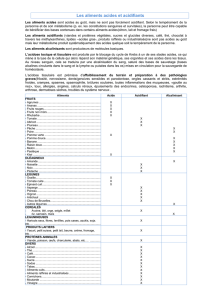
)D%&! ,)1,2+'%(-&! 2343-0&! 1%! *?! &3)'! 1%&! .3402(4%&! 23.*3-'+)'! 1%&! 13(/4%&! 4,+,&3)&! 23)B(>(0%&! E(,!
3)'!4+!2+*+2,'0!1%!2:+)>%-!1%!23(4%(-!&(,5+)'!4$+2,1,'0!1(!.,4,%(!%)5,-3))+)'6!!
D%&!13.+,)%&!1%!*?!104,.,'+)'!4+!F3)%!1%!5,-+>%!@3(!'%,)'%!&%)&,/4%!C!1%!E(%4E(%&!,)1,2+'%(-&!2343-0&!
&3)'!13))0%&!2,G1%&&3(&!H!!
'
!
I<"!
J<J!
?04,+)':,)%!!
-3(>%!
K3)%!1%!5,-+>%!H!3-+)>%!
B+()%!
!
L<M!
N<L!
O6O6P!
B+()%!
K3)%!1%!5,-+>%!H!5%-'!
/4%(!
!
Q<R!
"M!
S:0)3*:'+40,)%!!
T)2343-%!!
K3)%!1%!5,-+>%!H!U3&%!'-V&!*84%!
U3&%!W(2:&,+!
!
20"("#",&)H!S4+2%-!!"!.D!1%!&34(',3)!X"!%'!XR!!@!3(!XI!%'!XJ!C!1+)&!2:+E(%!'(/%&!9!%&&+,&6!!
U+B3('%-!E(%4E(%&!>3(''%&!1$()!,)1,2+'%(-!2343-0!B(1,2,%(&%.%)'!2:3,&,6!=>,'%-6!
@!=''%)',3)!H!D%&!,)1,2+'%(-&!2343-0&!+Y+)'!%(ZG.[.%&!1%&!*-3*-,0'0&!+2,13G/+&,E(%&<!)%!*+&!%)!
-+B3('%-!*4(&!1%!I!>3(''%&6!C!
!
!"#$%&'()7)+),&)-18%9(0&)
Mesurer'précisément'le'pH!1%!53&!1%(Z!&34(',3)&!%)!,)'-31(,&+)'!%)5,-3)!JM!.D!1%!2:+2()%&!1%!2%&!
&34(',3)&!1+)&!()!/02:%-6!
Déterminer l’incertitude-type u pH sur les mesures sachant que le fournisseur indique une précision de « ±
0,01 pH »
Déterminer'l’incertitude6élargie'UpH''sur'les'mesures!@\)!*-%)1-+!()!W+2'%(-!1$04+->,&&%.%)'!]!^!RC!
!
Précautions d’utilisation :
- Etalonnage du pH-mètre : Avant utilisation, un pH-mètre doit être étalonné avec deux solutions de pH connues à
la température de la salle. Cet étalonnage a déjà été réalisé.
- L’électrode en verre devra être complètement immergée dans la solution ( au moins 4 cm )
Pour des mesures isolées, il est impératif de bien laver et sécher la cellule entre les mesures ou de la rincer avec la
solution étudiée.
Les électrodes étant très FRAGILES, on fera attention de ne pas les cogner.
!
!
!"#$%&'():)+)),&4)4",$(/"'4)
\)!1,&*3&%!1%&!&34(',3)&!X"<!XR<!XI<!XJ!1%!23)2%)'-+',3)!.34+,-%!%)!&34('0!+**3-'0!!"<M6"MGR!.346DG"!H!
!G!X"!! =2,1%!2:43-:Y1-,E(% @!?_!@+EC!_!#4G!@+EC!C!!

Tp chimie mesures de pH des acides et des bases
!
!
R!
G!XR!! X34(',3)!1$+2,1%!0':+)3`E(%!@!#?I#\R?!@+EC!C!
G!XI!!X34(',3)!1$:Y1-3ZY1%!1%!&31,(.!@!A+_!@+EC!_!?\!G!@+EC!C!!
G!XJ!! X34(',3)!1$0':+)3+'%!1%!&31,(.!@!A+_@+EC!_!#?I#\\G@+EC!C!!
!
Travail'à'faire':'
Mesurer'le'pH'des'solutions'S1'et'S2'(groupe'A)'ou'S3'et'S4'(groupe'B)'par'les'trois'méthodes'présentées'
dans'les'documents'1,'2'et'3'et'répondre'aux'questions'suivantes':'quelle'est'la'méthode'la'plus'précise'?'
la'plus'rapide'?'la'moins'coûteuse'?'
Pour'cela'remplir'le'tableau'ci6dessous':'
'
!
!
!
!
II. force des acides
!
!"#$%&'();)+)06.#(/"')&'(0&)$').#/5&)&(),<&.$)
D%&!&34(',3)&!X"!%'!XR!3)'!0'0!3/'%)(%&!&(,'%!9!1%&!-0+2',3)&!%)'-%!()!+2,1%!@4$+2,1%!2:43-:Y1-,E(%<!
4$+2,1%!0':+)3`E(%C!%'!4$%+(!6!D$0E(+',3)!1%!2%''%!-0+2',3)!%&'!H!
=1)))))))>))))))13?@,A)))))B))))))=8)@.CA)))>)))))))17?>@.CA)
!
3a!=?!%&'!4$+2,1%6!
b+)&!4%!2+&!1%!4+!&34(',3)!X"!<!!=?!^!?#4@>C!%'!=G!@+EC!!!^!#4G@+EC!!
b+)&!4%!2+&!1%!4+!&34(',3)!XR<!!=?!^!#?I#\\?!%'!=G!@+EC!!!^!!#?I#\\G@+EC!
!
!"#$%&'()D)+)E"0#&)5&4).#/5&4)
• #%-'+,)&!+2,1%&!=?<!+**%40&!.#/5&4)E"0(4<!-0+>,&&%)'!'3'+4%.%)'!+5%2!4$%+(6!D$+2,1%!=?!)$%Z,&'%!
13)2!*+&!1+)&!4$%+(!c!,4!%&'!&3(&!4+!W3-.%!=G!@+EC!!!%'!?I\_@+EC!6!D%&!+2,1%&!W3-'&!&3)'!("(.,&%&'()
5/44"#/64)5.'4),<&.$F)
!
• #%-'+,)&!+2,1%&!-0+>,&&%)'!*+-',%44%.%)'!+5%2!4$%+(6!#%&!+2,1%&!&3)'!+**%40&!1%&!.#/5&4)E./G,&46!
=!4+!W,)!1%!4+!-0+2',3)<!'3('%&!4%&!%&*V2%&!W,>(-+)'!1+)&!4$0E(+',3)!1%!4+!-0+2',3)!&3)'!*-0&%)'%&!
@%)!*+-',2(4,%-!=?!%'!=GC6!D%&!+2,1%&!W+,/4%&!&3)'!-.0(/&,,&%&'()5/44"#/64)5.'4),<&.$6!
!
!"#$%&'()H)+),&)-1)
-1)B)8),"I)J17?>K)
!
*?!>-+)1%(-!&+)&!1,.%)&,3)!c!d?I\_e!%&'!()!)3./-%!E(,!%Z*-,.%<!%)!.346DG"<!4+!23)2%)'-+',3)!%)!,3)&!
3Z3),(.!?I\_@+EC!
#%''%!-%4+',3)!&$02-,'!+(&&,!H!!
J17?>K)B)*L8-1)
!
!
!
Groupe''
Solution'
Encadrement'du'pH'à'
l’aide'd’indicateurs'
colorés'
pH'estimé''
au'papier'
pH'
pH'mesuré'au''
pH6mètre'
pH'='…….±'''
Δ
'pH'
A'
S1'
'
'
'
A'
S2'
'
'
'
B'
S3'
'
'
'
B'
S4'
'
'
'
Avantages'et'inconvénients'
des'méthodes'
'
'
'

Tp chimie mesures de pH des acides et des bases
!
!
I!
'
Travail'à'faire':'
• Mesurer'le'pH'de'la'solution'S1'(volume'V1=100,0'mL)'
• A' l’aide' d’un' tableau' d’avancement' associé' à' la' réaction' correspondant' à' fabrication' de' la'
solution'S1'déterminer'la'valeur'de'l’avancement'maximal'xmax'
• A'partir'de'la'mesure'de'pH'déterminer'la'concentration'en'ions'oxonium'de'la'solution'S1';'en'
déduire'la'valeur'de'l’avancement'final'xf'
• Comparer'xf'et'xmax.'Conclure.'
• Mesurer'le'pH'de'la'solution'S2'(volume'V2'='100,0'mL)'
• A' l’aide' d’un' tableau' d’avancement' associé' à' la' réaction' correspondant' à' fabrication' de' la'
solution'S2'déterminer'la'valeur'de'l’avancement'maximal'xmax'
• A'partir'de'la'mesure'de'pH'déterminer'la'concentration'en'ions'oxonium'de'la'solution'S2';'en'
déduire'la'valeur'de'l’avancement'final'xf'
• Comparer'xf'et'xmax.'Conclure.'
'
!
!
!
III. relation entre pH et concentration en soluté apporté
!
!"#$%&'()M)+)20"("#",&)
On va réaliser des dilutions successives et mesurer le pH correspondant.
• f+'0-,%4!H/(-%''%!>-+1(0%<!*?G.V'-%<!*,*%''%!B+(>0%!1%!gM!.D<!/02:%-!1%!"MM!.D<!/+--%+(!
+,.+)'0<!+>,'+'%(-!.+>)0',E(%<!&(**3-'!
• X34(',3)&!H!&34(',3)&!X"!%'!XR<!%+(!1,&',440%!
Dans un bécher de 100 mL, introduire un volume Vo = 50,0 mL d’eau distillée à l’aide d’une burette
graduée ou d’une pipette jaugée de 50,0 mL. Ajouter mL par mL , à l’aide d’une burette graduée, un
volume V d’une solution S d’acide ou de base à la concentration Cs = 1,00x10-2 mol/ L. Homogénéïser la
solution à l’aide d’un barreau aimanté et d’un agitateur magnétique. Mesurer le pH.
La concentration de la solution présente dans le bécher est C = V x Cs / ( Vo + V )
!
!"#$%&'()N)+)O#.0()0&,.(/E)
!
é!"#$!!"#$%&' =!
!"#$%&!!ℎé!"#$%& −!"#$%&!!"#$%é!
!"#$%&!!ℎé!"#$%& !×100![%]!
!
D+!5+4%(-!':03-,E(%!1(!*h+!1%!4$+2,1%!0':+)3`E(%!%&'!1%!J<Ng6!
!
Travail'à'faire':'
A'l’aide'du'matériel'mis'à'votre'disposition'et'des'mesures'réalisées,'démontrer'les'relations'suivantes':'
• Acide'fort':'pH'='6'log'(c)''
• Acide'faible':'pH'=''½'pKa'6'½'log'(c)'
Où':'c'est'la'concentration'de'l’acide'et'pKa'est'une'constante'à'déterminer'(donner'un'écart'relatif)'
!
!

Tp chimie mesures de pH des acides et des bases
!
!
J!
!
1
/
4
100%