Activité n°2 : Caractérisation du produit d`oxydation obtenu

Mme GRISARD
CHAPITRE . . . . - T.P. n°. . . . .
1ère S . . .
Chimie B : La chimie créatrice
Oxydation ménagée des alcools
Date : . . . . . . . . .
NOM : . . . . . . . . . . . .
Prénom : . . . . . . . . . .
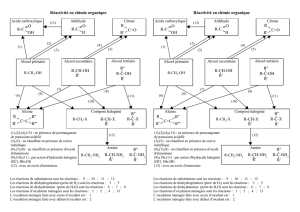
Objectifs : Lors de la réaction d’un alcool, reconnaître s’il s’agit d’une réaction d’oxydation, de déshydratation ou de
substitution. Connaître les familles de composés obtenus par oxydation ménagée d’un alcool. Écrire la
réaction d’oxydation d’un alcool par les ions permanganate en milieu acide.
Préliminaires : Risques et sécurité
1. Préciser les précautions expérimentales à prendre pour réaliser des expériences avec les espèces chimiques
organiques du T.P..
2. Compléter le tableau ci-dessous :
butan-1-ol
butan-2-ol
2-méthylpropan-2-ol
butanal
butan-2-one
Groupe
fonctionnel
et classe
Formule
topologique
Activité n°1 : Oxydation ménagée d’un alcool
Contrairement à la combustion qui transforme le composé organique en dioxyde de carbone et en eau, une réaction
d’oxydation ménagée conserve le squelette carboné de la molécule. Une oxydation ménagée est une oxydation douce
tandis que la réaction de combustion est une oxydation brutale.
Dans la manipulation proposée, les alcools sont
oxydés par une solution de permanganate de
potassium :
)aq(MnO)aq(K 4
, acidifiée
par de l’acide sulfurique, de concentration
2,0.10-2 mol.L-1.
On étudie l’oxydation ménagée d’un alcool
primaire, secondaire ou tertiaire.
Protocole :
Dans le ballon, posé sur un anneau en liège,
introduire, avec un entonnoir :
- quelques grains de pierre ponce,
- environ 15 mL de la solution de permanganate de potassium,
- environ 5 mL de butan-1-ol ou de butan-2-ol.
Porter le mélange à ébullition très douce et recueillir le produit qui distille, dans le tube à essai, sur une hauteur de
3 cm environ.
Avant d’arrêter le chauffage, retirer le tube à dégagement du tube à essai pour éviter un retour dans le ballon.
Activité n°2 : Caractérisation du produit d’oxydation obtenu :
Sous la hotte :
Dans le tube contenant la 2,4-dinitrophénylhydrazine (notée D.N.P.H.), verser une dizaine de gouttes du distillat
obtenu. Agiter le tube à essai, observer et conclure.
Si le premier test est positif, dans le tube contenant le réactif de Schiff, verser une dizaine de gouttes du distillat
obtenu bien refroidi et placer le mélange obtenu dans un bain d’eau glacée. Patienter quelques minutes en agitant
régulièrement. Observer et conclure.
Remarque : Le test au réactif de Schiff remplace ici le test à la liqueur de Fehling ou le test au réactif de Tollens, car si
le corps formé est très peu soluble dans l’eau le précipité rouge d’oxyde de cuivre(I) ou le miroir d’argent,
formé à l’interface phase organique/phase aqueuse n’est pas toujours facilement visible. Le réactif de Schiff est
une solution aqueuse d’un colorant violet (la fuschine) décolorée par du dioxyde de soufre. En présence d’un
aldéhyde, à froid et en milieu non basique, il reprend sa couleur initiale.

Mme GRISARD
CHAPITRE . . . . - T.P. n°. . . . .
Classe : . . .
Physique-Chimie
Oxydation ménagée des alcools
2
Activité n°3 : Récapitulation des résultats expérimentaux :
3. Compléter le tableau suivant : [(+) si le test est positif et (–) si le test est négatif.]
Test réalisé sur le produit
d’oxydation
Alcool ayant servi à
la réaction d’oxydation ménagée
Test à la
D.N.P.H.
Test au réactif
de Schiff
Produit
d’oxydation
obtenu
butan-1-ol
butan-2-ol
2-méthylpropan-2-ol
Conclure en généralisant à partir des résultats obtenus :
4. A quelle famille de composés conduit l’oxydation ménagée d’un alcool primaire, lorsque l’oxydant est en défaut ?
5. A quelle famille de composés conduit l’oxydation ménagée d’un alcool secondaire, lorsque l’oxydant est en
défaut ?
Activité n°4 : Approfondissements
6. Dans les conditions expérimentales de température et de pression, donner, en justifiant, le nom et l’état physique
(solide, liquide ou gazeux) des espèces chimiques présentes dans le ballon et dans le bécher.
7. Que faut-il faire généralement pour le 2-méthylpropan-2-ol avant de l’utiliser ?
8. En précisant les deux couples oxydant / réducteur mis en jeu, écrire l’équation de la réaction d’oxydation ménagée
d’un alcool primaire par une solution de permanganate de potassium en milieu acide sulfurique, l’oxydant étant en
défaut.
9. En précisant les deux couples oxydant / réducteur mis en jeu, écrire l’équation de la réaction d’oxydation ménagée
d’un alcool secondaire par une solution de permanganate de potassium en milieu acide sulfurique, l’oxydant étant
en défaut.
10. Déterminer les quantités d’ions permanganate et de butan-1-ol (o butnane-2-ol) qui ont été mises en présence dans
le ballon réactionnel.
11. Établir le tableau descriptif de l’état du système au cours de la transformation chimique réalisée et vérifier que
l’oxydant est introduit en défaut.

Mme GRISARD
CHAPITRE . . . . - T.P. n°. . . . .
Classe : . . .
Physique-Chimie
Oxydation ménagée des alcools
3
R : 10-20 36/37-67 S : 16 7/9-13-24/25-26-46
BUTAN-2-OL
X Xn
B
BU
UT
TA
AN
N-
-2
2-
-O
OL
L
C4H10O M = 74.12 g/mol
P.E. : 99 °C P.F. : -117 °C
99% min P. inflammation : 23 °C
Densité (20/4) : 0.81
Solubilité dans l’eau à 20 °C : 200 g/L
R : 10-20 22-37/38-41-67 S : 16 7/9-13-26-37/39-46
2-METHYLPROPAN-2-OL
X Xn F
2
2-
-M
ME
ET
TH
HY
YL
LP
PR
RO
OP
PA
AN
N-
-2
2-
-O
OL
L
C4H10O M = 74.12 g/mol
P.E. : 82 °C P.F. : 24 °C
99% min P. inflammation : 11 °C
Densité (20/4) : 0.78
Solubilité dans l’eau à 20 °C : 77 g/L
R : 11 S : 9-29-33
BUTANAL
F
B
BU
UT
TA
AN
NA
AL
L
C4H9O M = 72.11 g/mol
P.E. : 68-77 °C P.F. : -97 °C
99% min P. inflammation : -6 °C
Densité (20/4) : 0.80
Solubilité dans l’eau à 20 °C : 71 g/L
R : 11-36/37-66-67 S : 9-16-25-33
BUTAN-2-ONE
X Xi F
B
BU
UT
TA
AN
N-
-2
2-
-O
ON
NE
E
C4H10O M = 72.11 g/mol
P.E. : 79 °C P.F. : -86 °C
99% min P. inflammation : -1 °C
Densité (20/4) : 0.80
Solubilité dans l’eau à 20 °C : 290 g/L


Fiche de demande de matériel LABO de SCIENCES PHYSIQUES
Lycée Marcelin Berthelot, Pantin
LISTE DE MATERIEL T.P.
NOM
Classe
Salle
Date
Heure
Eve GRISARD
1ère S
TITRE : Oxydation des alcools
5
PAILLASSE ELEVES :
PAILLASSE PROFESSEUR :
Nombre de postes : x=
Au bureau :
Liste des phrases de risques et de
sécurité (photocopies)
Eprouvette graduée 25 mL
Eprouvette graduée de 10 mL en verre
Matériel nécessaire pour le montage ci-
dessous (démonté) :
Deux supports élévateurs (ou un seul
sous le bécher)
Chauffe-ballon + rallonge
Ballon posé sur support en Liège avec
bouchon adapté
Support avec pince (contact métal-verre
protégé)
Bouchon à trou et tube réfrigérant
2 tubes à essai avec bouchon
Bécher haut
Au frigo : glaçons (environ 80)
Le même montage que les élèves, le
ballon (prêt) contenant : 15 mL de
solution KMnO4, 5 mL de 2-
methylpropan 2-ol et pierre-ponce
Devant le bureau :
solution de permanganate de
potassium KMnO4 de concentration
environ 2.10-2 mol.L-1, acidifiée par de
l’acide sulfurique, (500 mL) avec
bécher
pierre ponce dans coupelle
Sous la hotte :
butan-1-ol avec bécher
butan-2-ol avec bécher
2-methylpropan 2-ol avec bécher
x tubes à essai bouchés contenant de la
D.N.P.H. (environ 1 mL)
x tubes à essai bouchés contenant du
réactif de Schiff (environ 1 mL) placés
dans un bain d’eau glacée (pour
maintenir les tubes droits, utiliser un
support de bain-marie par exemple)
Autre info : x = nombre total de postes
1
/
5
100%