SmortierBlaisePascalPC_courbes_intensite_potentiel

1
Courbes intensité-potentiel (i-E)
ou courbes de polarisation
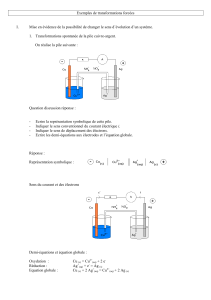
doc 1 : Transformation spontanée ou forcée en électrochimie
électrochimie : transfert d’e- entre une espèce en solution et une électrode
transformation spontanée : cas d’une pile
E
Pôle positif : cathode : réduction
ox2 + n e- red2 ox2 red2 (pôle +) cathode
Pôle négatif : anode : oxydation ox1 red1 (pôle - ) anode
red1 ox1 + n e-
transformation forcée : électrolyse
Une réaction d’électrolyse correspond à la somme de 2 réactions
électrochimiques qui se produisent au contact de 2 électrodes, reliées à un
générateur de courant, plongeant dans une solution électrolytique. Les 2
réactions ont lieu dans le sens non spontané grâce à l’énergie électrique
apportée par le générateur.
E
Pôle positif : anode : oxydation
red2 ox2 + n e- ox2 red2 (pôle +) anode
Pôle négatif : cathode : réduction ox1 red1 (pôle - ) cathode
ox1 + n e- red1
doc 2 : Mécanisme simplifié des échanges électronique
Transfert de charge au niveau de l’électrode :
Transfert d’e- entre l’électrode et l’espèce qui y est « accrochée »
( adsorption) : la transformation ox en red ou red en ox a alors lieu
Transfert de matière dans la solution :
Loin de l’électrode, la convection permet le déplacement des espèces sous
l’action de l’agitation mécanique
Près de l’électrode, il y a appauvrissement des espèces puisqu’elles se
transforment au contact de l’électrode ; il y a un gradient de concentration ; les
espèces diffusent des zones les + concentrées vers
les zones les – concentrées : loi de Fick
Modèle de la couche de Nernst en régime de diffusion convective.
Profil des concentrations dans le cas d'une réaction d'oxydation
Les ions migrent sous l’effet du champ électrique ( cations vers le pôle +, anions
vers le pôle - )

2
doc 3 : Montage expérimental ( à 3 électrodes )
cas de l’électrolyse
E.T : électrode de travail siège d’une oxydation ou d’une réduction suivant
le branchement au générateur
Eref : électrode de référence souvent ECS ; elle se détériore s’il y a passage d’un
courant
C.E : contre électrode souvent en Pt pour faire circuler les électrons
Suivant le sens du courant, l’électrode de travail peut être une anode ou
une cathode.
doc 4 : Electrolyse du solvant eau avec des électrodes de platine
Les courbes tendent vers l’infini car le solvant est par définition le constituant en
excès !
électrode
Pt
Fe
Zn
Hg
c ( en V)
-0,05
- 0,30
- 0,5
-0,6
Couple O2/H2O :
Electrode
Pt
Ti
a ( en V)
0,5
1,5
doc 5 : couples rédox en solution ( limitation par la diffusion )
ex d’un couple rapide : ex d’un couple lent :

3
doc 6 : Présence de plusieurs couples rédox
Supposons qu’on ait en solution aqueuse Ox1, red1, red2 ; on place dans un premier
temps les courbes i-E de chaque couple rédox et celles liées à l’eau indépendamment
les unes des autres :
Méthode : quand on part de l’équilibre ( i = 0 ) et qu’on fait varier le potentiel,
dès que le potentiel anodique ( ou le potentiel cathodique ) d’un couple est
atteint, l’intensité est la somme algébrique des intensités de chaque couple.
Oxydations possibles :
si Ea ( red2 ) > E > Ea (red1) : oxydation de red1
si Ea(H2O) > E > Ea(red2 ) : oxydation de red 1 et de red2
si E > Ea(H2O ) : on oxyde l’eau, red1 et red2.
Réductions possibles :
Si Ec(H2O)< E < Ec(ox1) : réduction de ox1
si E < Ec ( H2O) : réduction de H2O et Ox1.
doc 7 : ex de réactions rédox spontanées
Le magnésium est attaqué par de l’acide et on observe un dégagement gazeux intense, ce n’est
pas le cas du plomb. Or dans les 2 cas, une réaction est possible du point de vue
thermodynamique.

4
doc 9 : Obtention de zinc pur à 99,99 % par électrolyse
doc 8 : Electro-inactivité d’espèces
Toutes les espèces qui ont leur courbe i-E avant la courbe de réduction de l’eau ou après la
courbe d’oxydation de l’eau sont électro-inertes car la diffusion de l’eau vers l’électrode n’est
jamais l’étape limitante ; le courant peut alors prendre des valeurs importantes : c’est le mur
du solvant.
L’anode est en plomb et est recouverte de PbO2(s)
La cathode est en aluminium
Conditions industrielles : U = 3,2V
j(densité de courant) = 400 A/m2 = i/Sélectrode
Sélectrodes(2 faces) = 3 m2
Durée du dépôt : 48 h
On récupère le zinc en pelant la cathode ; on fond le zinc et on le coule en lingots de
25kg. Le zinc obtenu est pur à 99,99%
Hall d'électrolyse de l'usine Umicore de Balen (Belgique)
- 140 cellules avec par cellule :
- 96 cathodes
- 97 anodes
- surface électrodes : 3,2 m2
1
/
4
100%