Électrolyse : Acide Sulfurique & Chlorure de Sodium - Exercices

Electrolyses Page 1 sur 3
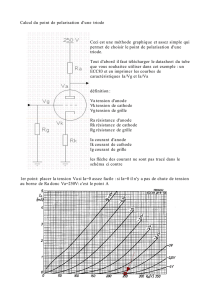
Electrolyse d’une solution d’acide sulfurique
I. MONTAGE
II. PRODUITS OBTENUS AUX ELECTRODES
1. Comparez les proportions des volumes de gaz obtenus.
2. Gaz obtenu à la cathode
3. Gaz obtenu à l’anode :
Conclusion :
III. ANALYSE THEORIQUE DE L’ELECTROLYSE
1) Faire l’inventaire des espèces présentes en solution. (Ne pas oublier les électrodes ainsi que le solvant)
2) Définir les espèces majoritaires
3) Les couples rédox à considérer sont :
O2(g)/H2O H+(aq)/H2(g)
2-
28
S O (aq)
/
2-
4
SO (aq)
2-
4
SO (aq)
/SO2(aq)
a) Quels sont les réducteurs présents en solution:
b) Quels sont les oxydants présents en solution:
c) Remplir le tableau ci-dessous: écrire les demi-réactions possibles à chaque électrode.
d) En utilisant les résultats expérimentaux en déduire les réactions qui se produisent aux électrodes
e) En déduire l’équation de fonctionnement de l’électrolyse de la solution d’acide sulfurique.
Conclure
f) L’acide sulfurique a-t-il été consommé ? Que peut-on dire de la concentration de l’acide au cours de l’électrolyse ?

Electrolyses Page 2 sur 3
A l’anode lieu des oxydations
Les réducteurs sont oxydés
A la cathode lieu des réductions
Les oxydants sont réduits
Solution
acide neutre
ou basique
Solutés
Solvant
Electrodes
IV. ETUDE QUANTITATIVE
Exemple de résultats expérimentaux
I = 0,30 A ; t = 649 s ; V(H2) = 22,0 mL ; V(O2) = 11,1 mL
1) Établir l'expression de la quantité d’électrons ayant circulé dans le circuit pendant la durée t en fonction de l'intensité I
du courant qui a circulé dans le circuit.
2) Établir le tableau descriptif de l'évolution du système à l'anode.(voir tableau ci-dessous)
3) Vérifier que le volume de dioxygène mesuré expérimentalement est en accord avec la valeur mesurée dans les
conditions de l'expérience.
4) Déterminer le volume théorique de gaz dihydrogène. Comparez cette valeur à la valeur expérimentale.
Équation de la réaction
2H2O(l) = O2(g) + 4H+(aq) + 4e-
Quantité de matière dans
l’état initial à t = 0 (mol)
Quantité de matière au cours
de la transformation à une
date t (mol)
Quantité de matière à la fin
de l'électrolyse (mol)
Tableau descriptif de l'évolution du système à l’anode
A mémoriser :
Le dioxygène est toujours obtenu à l’anode (oxydation de l’eau)
Le dihydrogène est toujours obtenu à la cathode (réduction de l’eau)
Couples de l’eau
L’eau est un réducteur, on considère les couples O2(g)/H2O en milieu acide ou neutre O2(g)/HO- (aq) en milieu basique.
L’eau est un oxydant on considère les couples H2O(l) / H2(g) en milieu basique ou neutre et H+(aq)/H2(g) en milieu acide.
Ecrire les demi-équations.

Electrolyses Page 3 sur 3
V. EXERCICE
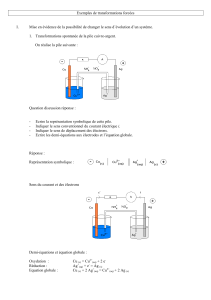
On réalise dans un tube en U l’électrolyse d’une solution de chlorure de sodium avec des électrodes en graphites inattaquables.
On obtient à la cathode du dihydrogène et des anions hydroxydes
On obtient à l’anode du dichlore.
1) Faire le schéma (voir électrolyse précédente)
2) Faire l’inventaire des espèces présentes en solution. (Ne pas oublier les électrodes ainsi que le solvant eau)
3) Définir les espèces majoritaires
4) Les couples rédox à considérer sont :
O2(g)/H2O H2O(l) / H2(g) Cl2(g)/ Cl– (aq) Na+ (aq)/ Na
a) Quels sont les réducteurs présents en solution:
b) Quels sont les oxydants présents en solution:
c) Remplir le tableau ci-dessous: écrire les demi-réactions possibles à chaque électrode.
d) En utilisant les résultats expérimentaux en déduire les réactions qui se produisent aux électrodes (compléter le
tableau ci-dessous.
e) En déduire l’équation de fonctionnement de l’électrolyse de la solution de chlorure de sodium
A l’anode lieu des oxydations
Les réducteurs sont oxydés
A la cathode lieu des réductions
Les oxydants sont réduits
Solution
acide neutre
ou basique
Solutés
Solvant
Electrodes
Electrolyse d’une solution de chlorure de sodium
Demi-équations
Equation de
fonctionnement
1
/
3
100%