TP DE CHIMIE PCL : PILE ET ELECTROLYSE 1. Etude introductive

TP DE CHIMIE PCL : PILE ET ELECTROLYSE
1. Etude introductive
a. Questions préliminaires
On rappelle le numéro atomique de l’élément chlore Cl : Z = 17.
1) Ecrivez la structure électronique de l’atome de Chlore (remplissage des couches K, L, M).
2) Déduisez-en l’ion stable formé à partir de cet atome.
3) En appliquant l’électroneutralité au composé SnCl
2
, donnez la formule de l’ion formé à partir de
l’atome d’étain Sn.
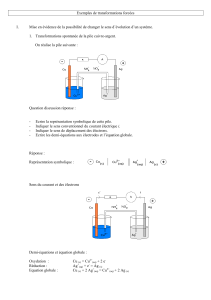
b. Montage
Réalisez le montage suivant :
2. Electrolyse d’une solution de chlorure d’étain SnCl
2
Réalisez le montage suivant :
Solution de chlorure
d’étain SnCl
2
Electrodes de graphite
Générateur de tension variable
+
_
(1)
(2)
Solution de chlorure
d’étain SnCl
2
Electrodes de graphite
(1)
(2)
Résistance
On donne les couples oxydants/réducteurs
suivants : Sn
2+
/Sn, Cl
2
/Cl
-
, H
2
O/H
2
et O
2
/ H
2
O.
1)
Quels sont , parmi les espèces chimiques
de ces couples, celles présentes
initialement ?
Par ordre de pouvoir oxydant croissant
, on
donne : Sn
2+
, H
2
O, O
2
et Cl
2
.
2)
Placez les quatre couples
oxydants/réducteurs sur un axe do
uble
gradué en pouvoir oxydant croissant et
pouvoir réducteur croissant.
3) Quelle(s) réaction(s) spontanées (qui se
déroulent sans l’aide d’un générateur)
peuvent se dérouler
? Justifiez votre réponse.
Branchez un ampèremètre de façon à mesurer l’intensité du courant circulant dans le circuit.
4) Votre mesure est-elle en accord avec la réponse à la question 3) ?
a. Etude expérimentale
Une fois le montage réalisé, faite-le vérif
ier
par le professeur.
Allumez le générateur et attendez
quelques instants.
1) Qu’observez vous à l’électrode n°1 ?
2) Qu’observez vous à l’électrode n°2 ?
Eteignez le générateur.
b. L’électrolyse, une réaction chimique forcée
1) Sur le schéma du montage, indiquez le sens de circulation du courant d’intensité I.
2) Qui transporte le courant dans les fils électriques ? dans la solution ?:
3) Rappelez comment est défini le sens du courant d’intensité I par rapport à celui des électrons (voir
TP pile Daniell).Déduisez-en le sens de circulation des électrons dans le circuit. Indiquez le sur le
schéma.
4) Déduisez de la question précédente la nature de la réaction chimique se déroulant à l’électrode
n°1, puis à l’électrode n°2 :
5) Représentez le sens de circulation des ions dans la solution.
6) On rappelle que, l’électrode qui est le siège d’une réduction s’appelle la cathode. Quelle est
l’électrode qui correspond à la cathode ? A quel pôle du générateur est-elle reliée ?
L’électrode qui est le siège d’une oxydation s’appelle l’anode. Quelle est l’électrode qui correspond à
la cathode ? A quel pôle du générateur est-elle reliée ?
7) Ecrivez les équations des réactions chimiques se déroulant à la cathode et à l’anode.
Sont-elles en accord avec vos observations faites au 1) ?
Déduisez-en l’équation bilan de fonctionnement de l’électrolyse.
Bilan : Quelles sont les différences entre le fonctionnement d’une pile et d’une électrolyse ?
3. Activité documentaire : description de la pile à combustible
Répondez aux questions suivantes :
1) On donne les couples oxydants/réducteurs suivants : H
2
O/H
2
et O
2
/ H
2
O. Rappelez la nature de la
réaction se déroulant à la cathode ? à l’anode ?
2) En déduire l’ espèce qui réagit à la cathode ? l’ espèce qui réagit à l’anode ?
Complétez les équations suivantes avec les électrons e
-
manquants :
H
2
→ 2 H
+
et O
2
+ 4H
+
→ 2H
2
O
3) Ecrire l’équation bilan du fonctionnement de cette pile.
4) Quels sont les avantages de cette pile par rapport aux autres ?
5) Quelles sont les obstacles que rencontre son exploitation ?
6) Recherchez le nom d’ autres piles « classiques » d’usage courant.
Une pile à combustible est une pile
continuelle
ment alimentée en réactifs et dont les
produits sont éliminés en continu. De telles piles
sont utilisées dans les engins spatiaux.
Cependant, leur alimentation soulève encore des
problèmes
; elles sont encombrantes, trop
lourdes et de coût trop élevé pour
entrer dans le
domaine grand public. Des recherches se
poursuivent, car leur rendement élevé et leur
faible pollution en font des systèmes d’avenir.
Schéma d’une pile à combustible
1
/
1
100%