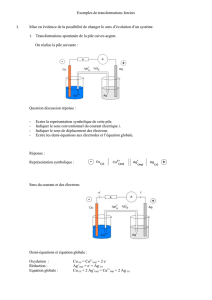
I) Principe

1
Courbes intensité-potentiel (i-E)
ou courbes de polarisation
doc 1 : Transformation spontanée ou forcée en électrochimie
électrochimie : transfert d’e- entre une espèce en solution et une électrode
• transformation spontanée : cas d’une pile
E
Pôle positif : cathode : réduction
ox2 + n e- red2 ox2 red2 (pôle +) cathode
Pôle négatif : anode : oxydation ox1 red1 (pôle - ) anode
red1 ox1 + n e-
• transformation forcée : électrolyse
Une réaction d’électrolyse correspond à la somme de 2 réactions
électrochimiques qui se produisent au contact de 2 électrodes, reliées à un
générateur de courant, plongeant dans une solution électrolytique. Les 2
réactions ont lieu dans le sens non spontané grâce à l’énergie électrique
apportée par le générateur.
E
Pôle positif : anode : oxydation
red2 ox2 + n e- ox2 red2 (pôle +) anode
Pôle négatif : cathode : réduction ox1 red1 (pôle - ) cathode
ox1 + n e- red1
doc 2 : Mécanisme simplifié des échanges électronique
Transfert de charge au niveau de l’électrode :
Transfert d’e- entre l’électrode et l’espèce qui y est « accrochée »
( adsorption) : la transformation ox en red ou red en ox a alors lieu
Transfert de matière dans la solution :
• Loin de l’électrode, la convection permet le déplacement des espèces sous
l’action de l’agitation mécanique
• Près de l’électrode, il y a appauvrissement des espèces puisqu’elles se
transforment au contact de l’électrode ; il y a un gradient de concentration ; les
espèces diffusent des zones les + concentrées vers
les zones les – concentrées : loi de Fick
Modèle de la couche de Nernst en régime de diffusion convective.
Profil des concentrations dans le cas d'une réaction d'oxydation
• Les ions migrent sous l’effet du champ électrique ( cations vers le pôle +, anions
vers le pôle - )

2
doc 3 : Montage expérimental ( à 3 électrodes )
cas de l’électrolyse
• E.T : électrode de travail siège d’une oxydation ou d’une réduction suivant
le branchement au générateur
• Eref : électrode de référence souvent ECS ; elle se détériore s’il y a passage d’un
courant
• C.E : contre électrode souvent en Pt pour faire circuler les électrons
Suivant le sens du courant, l’électrode de travail peut être une anode ou
une cathode.
doc 4 : Electrolyse du solvant eau avec des électrodes de platine
Les courbes tendent vers l’infini car le solvant est par définition le constituant en
excès !
électrode
Pt
Fe
Zn
Hg
ηc ( en V)
-0,05
- 0,30
- 0,5
-0,6
Couple O2/H2O :
Electrode
Pt
Ti
η
a ( en V)
0,5
1,5
doc 5 : couples rédox en solution ( limitation par la diffusion )
ex d’un couple rapide : ex d’un couple lent :

3
doc 6 : Présence de plusieurs couples rédox
Supposons qu’on ait en solution aqueuse Ox1, red1, red2 ; on place dans un premier
temps les courbes i-E de chaque couple rédox et celles liées à l’eau indépendamment
les unes des autres :
Méthode : quand on part de l’équilibre ( i = 0 ) et qu’on fait varier le potentiel,
dès que le potentiel anodique ( ou le potentiel cathodique ) d’un couple est
atteint, l’intensité est la somme algébrique des intensités de chaque couple.
Oxydations possibles :
• si Ea ( red2 ) > E > Ea (red1) : oxydation de red1
• si Ea(H2O) > E > Ea(red2 ) : oxydation de red 1 et de red2
• si E > Ea(H2O ) : on oxyde l’eau, red1 et red2.
Réductions possibles :
• Si Ec(H2O)< E < Ec(ox1) : réduction de ox1
• si E < Ec ( H2O) : réduction de H2O et Ox1.
doc 7 : ex de réactions rédox spontanées
Le magnésium est attaqué par de l’acide et on observe un dégagement gazeux intense, ce n’est
pas le cas du plomb. Or dans les 2 cas, une réaction est possible du point de vue
thermodynamique.

4
doc 9 : Obtention de zinc pur à 99,99 % par électrolyse
doc 8 : Electro-inactivité d’espèces
Toutes les espèces qui ont leur courbe i-E avant la courbe de réduction de l’eau ou après la
courbe d’oxydation de l’eau sont électro-inertes car la diffusion de l’eau vers l’électrode n’est
jamais l’étape limitante ; le courant peut alors prendre des valeurs importantes : c’est le mur
du solvant.
• L’anode est en plomb et est recouverte de PbO2(s)
• La cathode est en aluminium
Conditions industrielles : U = 3,2V
j(densité de courant) = 400 A/m2 = i/Sélectrode
Sélectrodes(2 faces) = 3 m2
Durée du dépôt : 48 h
On récupère le zinc en pelant la cathode ; on fond le zinc et on le coule en lingots de
25kg. Le zinc obtenu est pur à 99,99%
Hall d'électrolyse de l'usine Umicore de Balen (Belgique)
- 140 cellules avec par cellule :
- 96 cathodes
- 97 anodes
- surface électrodes : 3,2 m2
1
/
4
100%