Formation d`une image par une lentille mince

Chapitre 12
TP : TRANSFORMATIONS FORCÉES : ELECTROLYSES
Objectifs.
Mise en évidence expérimentale de la possibilité, dans certains cas, de changer le sens d’évolution d’un
système.
Effectuer un bilan qualitatif et quantitatif d'une électrolyse.
I Les couples Zn 2+ / Zn et I2 / I –
1 - Recherche de l’évolution spontanée
Réactifs disponibles : poudre de zinc ; solution de sulfate de zinc de concentration 1.10 –2 mol.L –1 ; eau iodée de
concentration 1,0.10 –2 mol.L -1 ; solution d’iodure de potassium de concentration 1.10 –2 mol.L –1 ; soude .
Déterminer expérimentalement le sens d’évolution spontanée . Décrire avec soin le protocole utilisé .
Ecrire l'équation de la réaction associée à cette transformation chimique spontanée.
Par un calcul de quotient de réaction initial, montrer que le sens d’évolution trouvé est bien celui prévisible
théoriquement .
Que peut-on dire du taux d’avancement final de la réaction ?
Donnée : K = 6.10 46
2 – La transformation forcée
La réaction inverse est-elle susceptible de se produire ? Calculer sa constante d’équilibre . Conclure.
Est-il possible de forcer ce système à évoluer dans le sens de la formation de Zinc et de diiode ?
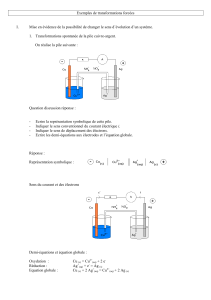
a - Expérience
Réaliser le montage suivant :
Ajuster la tension aux bornes du générateur à 15 V.
Fermer l’interrupteur .
Observer les électrodes et l’aspect de la solution
autour de celles-ci.
Introduire 2 mL de cyclohexane du coté où un phénomène
coloré se produit et observer.
b. Exploitation.
Qui impose le sens de déplacement des porteurs de charge ? Reproduire le schéma du montage électrique et
y faire figurer le sens de déplacement de tous les porteurs de charge et celui du courant électrique imposé.
Proposer une interprétation des phénomènes observés aux électrodes .
Ecrire les demi-équations se produisant à chaque électrode . Préciser leur nature .
Ecrire l'équation globale associée à la transformation électrochimique réalisée.
Comment évolue le quotient de réaction au cours d’une telle transformation ?
Electrodes en graphite
+
–
cathode
anode
solution
d’iodure
de zinc(II)
tube en U

II. Aspect quantitatif d'une électrolyse : électrolyse de l'eau en milieu acide
1 - Expérience.
Introduire 100 mL d'eau distillée dans l'électrolyseur. Remplir les éprouvettes graduées avec de l'eau distillée
et les retourner, sans bulles d'air, sur les électrodes.
Ajouter 10 mL d'acide sulfurique à 2 mol.L-1 dans la cuve de l'électrolyseur.
Homogénéiser la solution à l'aide d'un agitateur et ce, particulièrement entre les électrodes.
Réaliser le montage en série comprenant : un générateur de tension continue réglable, un électrolyseur, un
multimètre utilisé en mode ampèremètre, un interrupteur.
Fermer l'interrupteur tout en déclenchant le chronomètre et ajuster la
tension aux bornes du générateur pour que l’intensité du courant soit de
l’ordre de 0,3 A.
Observer.
Arrêter l’électrolyse lorsque le volume le plus grand dégagé à une électrode
vaut 10 mL .
Mesurer la valeur du volume de gaz dégagé à l'autre électrode.
Identifier les gaz formés.
2 - Exploitation.
Données : Couples oxydant/réducteur
O2(g)/H2O H+(aq)/H2(g)
2-
28
S O (aq)
/
2-
4
SO (aq)
2-
4
SO (aq)
/SO2(aq)
VM = 24 L.mol -1
A partir de l'inventaire des espèces chimiques présentes dans la solution et du sens de circulation
des électrons, écrire les équations de réaction possibles à chaque électrode.
Au vu des observations, indiquer les réactions qui se produisent réellement aux électrodes.
Établir l'expression de la quantité d’électrons ayant circulé dans le circuit pendant la durée
t en fonction de
l'intensité du courant qui a circulé dans le circuit.
Établir le tableau descriptif de l'évolution du système à l'anode.
Vérifier que le volume mesuré expérimentalement est en accord avec la valeur calculée dans les conditions
de l'expérience.
Écrire l'équation de la réaction associée à l’électrolyse.
Vérifier que le rapport des volumes dégagés est en accord avec le rapport des quantités de matière à l'état
final.
III- Electrolyse d’une solution de chlorure de sodium
Réaliser le montage ci contre. Régler le générateur
pour que la tension soit de
l’ordre de 3V . Fermer l’interrupteur et observer.
Quelles sont les réactions susceptibles de se produire
à l’anode et à la cathode ?
Données : O2 / H2O Cl2/Cl- H2O / H2 Na+/Na
Quelles sont les produits effectivement formés ?
En déduire l’équation traduisant l’électrolyse.
Quelles peuvent-être les applications de cette électrolyse ?
A
cathode
+
I
anode
eau + acide
sulfurique
–
cathode
anode
Phénolphtaleine
Solution de
NaCl 1 mol. L-1
A
-
+
Indigo
1
/
2
100%