Télécharger

Programme de colle de chimie
Semaine du 02 Mai
Chapitre 13 : réactions d’oxydoréduction
- Définir un oxydant, un réducteur, un couple oxydant-réducteur, une réaction
d’oxydation, de réduction.
- Définir et calculer le nombre d’oxydation d’un élément dans un édifice polyatomique
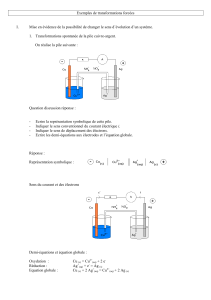
- Décrire le fonctionnement d’une pile électrochimique (exemple du cours : la pile
Daniell) : demi-pile, électrodes, pont salin…
- Définir l’anode et la cathode
- Définir la capacité d’une pile
- Décrire l’électrode de référence qu’est l’électrode standard à hydrogène
- Définir le potentiel d’électrode (ou potentiel rédox)
- Définir le potentiel standard d’électrode (ou potentiel standard d’oxydo-réduction)
- Connaître et utiliser la formule de Nernst
- Connaître les électrodes de référence au calomel, au chlorure d’argent. Décrire
succinctement leur fonctionnement.
- Tracer un diagramme de prédominance ou d’existence en fonction du potentiel
rédox
- Prévoir qualitativement l’évolution d’un système en comparant les valeurs des
potentiels rédox
- Prévoir quantitativement si une réaction rédox est favorisée ou non en calculant la
constante thermodynamique d’équilibre à l’aide des potentiels standards
A venir : diagrammes E-pH, l’accent sera mis sur l’utilisation d’un diagramme fourni et non
sur sa construction.
1
/
1
100%