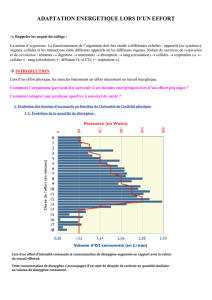
MARBACH Gérard

MARBACH Gérard PHYSIOLOGIE
Chap I : La cellule et les différents
tissus.
I. I. La chimie de la vie.
A. A. Les atomes et molecules.
Atome = particule qui ne peut pas être coupé ( a-tomos ).
Une molécule est formée de plusieurs atomes identiques ou différents. Plusieurs
molécules ensemble sont appelés Macromolécules.
1. 1. Eléments et composes de la matière.
Un élément est une substance impossible à découper en d’autre substances plus
petites au cours d’une réaction chimique. Il y a 92 éléments naturels plus un certain
nombres d’éléments artificiels.
Ex : Hydrogène ( H ) ; Carbone ( C ) ; Oxygène ( O ) ; Azote ( N ) qui sont les plus
courant dans l’organisme.
Les éléments peuvent se combiner dans des proportions définies pour former des
corps composés.
Ex : Na + Cl NaCl.
2. 2. Eléments essentiels de la vie.
25 des 92 éléments naturels se trouvent dans l’organisme :
Les 4 principaux représentent 96% dans l’organisme : 0, C, H, N.
7 sont important : Ca, P ( Phosphore ), K, S, Na, Cl, Mg ( Magnésium ).
Puis il reste les oligo-éléments.
Il existe des maladies de carence qui portent sur les oligo-éléments et
accessoirement sur les 7 éléments important .
3. 3. Structure de l’atome.
a) a) Particule élémentaire.
Un atome possède un noyau autour duquel gravite des électrons. Le noyau est
formé de protons et de neutrons.
Electron ( Vitesse de déplacement = vitesse de la lumière )
Noyau : proton + électrons

b) b) Numéro atomique.
Les numéros atomiques des éléments diffèrent par le nombre de leur particule
élémentaire ; il est donné par le nombre de proton. Leur poids dépend principalement
du nombre des protons et des neutrons car le poids des électrons est négligeable.
Ex : H : 1 proton Numéro atomique :1
He : 2 protons + 2 neutrons Numéro atomique : 2.. Masse = 4x
supérieur à H
c) c) Isotopes.
nombre de neutrons + nombre de protons
42He
nombre de protons
Tous les atomes d’un élément donné possède le même nombre de protons mais
le nombre de neutrons peut être différent ce qui détermine l’existence d’éléments
proche appelés Isotopes.
Ex : 126C ; 136C ; 146C.
Ils sont beaucoup utilisés en Médecine et en physiologie pour des examens
biologique.
Ex : 131I utilisé pour tester les activité de la thyroïde.
4. 4. Solutions aqueuses.
Dans l’organisme , la plus part des réactions chimiques se passent dans l‘eau et la
concentration des solutés dans l’eau est un élément essentiel. La concentration
s’exprime de 2 manières :
- Poids par volume : [NaCl]=10g/l dans le plasma
- Mol pas litre
Masse atomique = poids d’un atome de l’élément par apport au poids de
l’hydrogène pris comme unité.
Si H=1, C=12 O=16.
16g d’oxygène = 6x1023 atomes nombre d’Avogadro.
a) a) Acides, bases et pH
dissociation de l’eau : H2O M=18
Dans un certain volume d’eau, certaine molécules se dissocient ( elles sont au
nombre de 10-7 ) :
H2O OH- + H+.
Acides et bases.
Acides : substance qui cède des ion H+ (=proton).
Bases : substance qui capte des ion H+.
D’après la réaction précédente on en déduit que H2O est acide faible et que OH-
est une base faible.
Autres ex : HCl H+ + Cl-
1 molécule sur 10 se dissocie. Donc HCl est un acide fort car il a plus tendance a
céder son hydrogène que l’eau.

NaOH Na++ OH-
1 molécule sur 1014 se dissocie.
pH.
C’est une manière simple de représenter le degré d’acidité d’un milieu. Il rend
compte selon une échelle logarithmique de la proportion de molécule dissocié. L’eau
pure est neutre.
pH = 7 neutralité ;
pH > 7 alcalinité ;
pH < 7 acidité.
Ex : pH du plasma = 7,35 à 7,45
Solution tampon.
Ensemble de substance qui ajouté à une solution empêche une variation trop
importante de son pH lorsqu’on y ajoute un acide ou base fort. Il en existe une
dizaine dans l’organisme. Le plus courant est celui formé par l’acide carbonique
CO3H2 et le bicarbonate de sodium CO3HNa.
Ex : HCl + CO3HNa NaCl + CO3 H2
NaOH + CO3H2 H2O + CO3HNa.
B. B. Les substances organiques.
Ce sont des substances qui ne se trouvent que dans les organismes vivant ou qui
en dérivent, contrairement aux substances minérales qui existent aussi à l’état libre
dans le monde inanimé.
1. 1. Les glucides glucos = sucré.
Les glucides sont des substances constituées de C, H, O2, et qui se subdivise en
3 catégories.
a) a) Les monosaccharides.
( CH2O ) n
Si n=6 hexoses. Ex : C6 H12 O6 = glucose, fructose ou galactose.
Si n=5 pentoses. Ex: C5 H10 O5 = ribose, désoxyribose.
Ce sont les nutriments essentiels de toutes les cellules. Certaine n'utilisent que ce
nutriment. Ex: les cellules nerveuses; hématies.
Nutriment : partie utilisable d'un aliment.
b) b) Les disaccharides.
Ils sont formés par l'union de 2 monosaccharides. Les plus courants sont :
Le maltoses : glucose + glucose;
Le lactose : glucose + galactose;
Le saccharose : glucose + fructose.
c) c) Les polysaccharides.
Ils sont constitués par l'union d'un grand nombre de monosaccharides en général
disposés sous forme de disaccharides. Il en existe deux sortes :

Les polysaccharides de réserves : ils représentent une
réserve énergétique de l'organisme comme l'amidon ( maltose + maltose + ... + ... )
ou le glycogène que l'on trouve dans le foie et dans les muscles.
Les polysaccharides de structure : ils interviennent dans la
structure de la cellule. Il n'y en a pas dans la cellule humaine mais dans les cellules
végétales. Ex: cellulose (nous ne disposons pas des enzymes nécessaires à
métaboliser la cellulose mais celle-ci est importante dans l'alimentation pour servir de
balai ou fibre); chitine ( insecte, crevette).
2. 2. Les lipides lipos = gras.
C'est un grand nombres de substances constitués de C, H, O et qui ont une
propriété commune qui est de ne pas être hydrosoluble.
a) a) Les graisses: macrormolécules.
Ce sont des lipides constitué d'une molécule d'alcool appelé glycérol sur laquelle
sont fixés un certain nombre d'acides gras comme l'acide butyrique. Ex: triglycéride (
3x glycerole ).
Les graisses existent sous 2 formes:
Les graisses saturées : elles ont un maximum d'atomes
d'hydrogène c'est-à-dire qu'il n'y a pas de liaison libre pour fixer d'autres atomes. Ex:
toutes les graisses animales (lard, beurre).
Les graisses insaturées ou non-saturées : elles possèdent
des liaisons susceptibles de fixer d'autres substances par exemple l'hydrogène. Ex:
l'huile végétale.
b) b) Phosphoglycérolipide.
Ce sont des graisses qui entrent dans la constitution de toutes les cellules. La tête
est constituée d'une molécule de glycérol qui est hydrophile et sur laquelle est situé
le phosphore et les queues sont formées par un ou plusieurs acides gras et sont par
conséquent hydrophobes.
c) c) Les stéroïdes.
hydrophil
e
hydrophobe

Ce sont des lipides chimiquement dérivés du noyau cholestérol qui lui-même
comporte 4 cycles.
Le cholestérol est à la base de la synthèse de nombreuses hormones
(testostérone, progestérone, anabolisant ) et de la vitamine D, c'est donc une
substance indispensable à la vie.
3. 3. Protéines ( protides ) protos = premier
Appelé protide dans l'alimentation et protéine dans l'organisme. Il se compose de
C, H, O, N, P, S. Ils représentent 50% du poids sec de l'organisme chez le sujet
standard.
a) a) Les Acides aminés.
Il en existe 20 en tout. Ce sont les éléments de base qui constitue toutes les
protéines. Chimiquement, ils comportent un radical, R, sur lequel sont fixé un
groupement appelé carboxyle : COOH et un groupement amine NH2.
COOH
R
NH2
Certains de ces acides aminés ne peuvent pas être synthétisé par l'organisme et
doivent donc être présent dans l'alimentation de tous les jours. Ex: valine,
argumine...
b) b) Les polypeptides.
Ce sont des protéines formés par l'union d'un nombre parfois très élevé d'acide
aminés. Ils sont rattachés sous forme de chaîne allongées ou ramifiés ou circulaires.
4. 4. Les acides nucléides.
Ce sont des protéines de constitutions particulière qui existent dans le noyau de la
cellule ou ils sont produit.
a) a) Fonctions.
Le plus important des acides aminés est l'ADN ou acide
désoxyribonucléique. C'est une molécule très longue en forme d'échelle doublement
spiralés qui porte les caractères héréditaires de l'espèce et de l'individu. L'ADN peut
donc se transmettre d'une génération à l'autre et c'est la seule molécule qui fournit
les directives pour sa propre multiplication ou réplication.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
1
/
53
100%