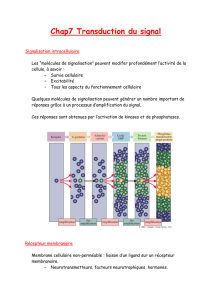
7.3 Distribution du nAChR et régulation de l`expression des

Next: 8. The Ligand Gated Up: No Title Previous: 6. Abréviations utilisées
Sous-sections
7.1 Génétique et biologie moléculaire des sous-unités du nAChR
7.2 Structure quaternaire et pharmacologie des nAChRs
7.3 Distribution du nAChR et régulation de l'expression des sous-unités
o 7.3.1 ARN messager codant pour les sous-unités
o 7.3.2 Sous-unité protéique
o 7.3.3 Sites de liaison fonctionnels
o 7.3.4 Récepteurs identifiés
o 7.3.5 Régulation de l'expression
7.4 Physiologie des nAChRs
7.5 Implication des nAChRs en comportement et pathologie
7.6 Conclusion
7. Les récepteurs nicotiniques neuronaux de
l'acétylcholine
Il est maintenant bien établi que le composant addictif principal du tabac est la nicotine. Cet
alcaloïde est actif chez l'homme car il mime l'action d'une molécule endogène, l'acétylcholine
(ACh) et interfère avec des processus physiologiques. La nicotine agit comme agoniste sur
l'un des deux types de récepteur de l'ACh, appelé pour cette raison récepteur nicotinique de
l'acétylcholine (nAChR). Ces récepteurs appartiennent à la superfamille des canaux ioniques
activés par des ligands (ligand-gated ion channels ou LGIC) [60,122] engagés dans les
réponses rapides aux neurotransmetteurs (voir le chapitre 8). Les nAChRs constituent une
famille de protéines transmembranaires pentamériques (Figure 7.1) formant un canal ionique
à travers la membrane plasmique dont l'ouverture est provoquée par un ligand endogène
(comme l'acétylcholine) ou par des substances exogènes (comme la nicotine).
Les nAChRs sont présents à travers tout le règne animal. Dans cette thèse toutefois, je me
focaliserai sur les nAChRs des mammifères, et particulièrement sur les nAChRs des rongeurs,
qui sont de loin les mieux caractérisés.
Figure : 7.1 Structure du nAChR. A gauche, structure 3D schématique. Le récepteur est ancré
dans la membrane au niveau de la constriction. Au centre, topologie transmembranaire d'une
sous-unité. TM2, coloré en noir, longe le pore. A droite, vue transversale du récepteur,
montrant la position du site de liaison de l'ACh. A, B, C forment le composant principal, D, E,
F forment le composant complémentaire.

7.1 Génétique et biologie moléculaire des sous-unités du
nAChR
La transmission nicotinique à la jonction neuro-musculaire fut le tout premier modèle de
transmission nerveuse étudiée [21] et le nAChR a été le premier récepteur de
<< signalement >> identifié comme tel [181]. L'existence de nAChRs différents dans le
muscle et les neurones est connue depuis un demi-siècle [248]. La diversité pharmacologique
des récepteurs neuronaux eux-mêmes a été révélée plus récemment, encore que bien avant les
études de biologie moléculaire [249].
Les études biochimiques, réalisées chez la torpille et le gymnote dans les années 70, ont
permis de purifier le nAChR [47] et de découvrir que c'était une protéine pentamérique
formée de quatre sous-unités différentes [344]. Elles ont été nommées , , , , selon leur
poids moléculaire. Plus tard, une autre sous-unité a été découverte, remplaçant dans le
muscle mature des tétrapodes. Elle fut appelée (sic). Pour une revue << historique >> on
peut voir [43].
Les méthodes de clonage moléculaire ont révélé l'existence de gènes homologues codant les
sous-unités du nAChR du système nerveux des osteichthiens [65], revue dans [184] [Figure
7.2].
Figure 7.2 : Alignement de toutes les séquences de sous-unités humaines. L'alignement a été

réalisé avec CLUSTALW[317]. En orange sont figurés les acides aminés appartenant au
composant principal du site de liaison. En bleu sont figurés les acides aminés appartenant au
composant complémentaire du site de liaison. Les cadres rouges encerclent le peptide signal et
les segments transmembranaires. Ces derniers ont été prédis par TMpred. Ce service est
disponible en ligne sur le WorlWide Web à l'URL:
http://ulrec3.unil.ch/software/TMPRED_form.html
Chez les vertébrés, onze sous-unités << neuronales >> ont été clonées à ce jour. Les sept

sous-unités possédant deux cystéines adjacentes, importantes pour la liaison de l'ACh [168]
ont été nommées 2-8. Les autres ont été nommées non- 1-3, terme rapidement (et
malheureusement) changé en 2-4 [290]. Une autre sous-unité, 9, a été découverte plus
récemment. Elle est exprimée dans les tissus épithéliaux et musculaires [98] mais n'a jamais
été trouvée dans les neurones jusqu'à aujourd'hui. Elle ne peut donc être appelée neuronale
(bien que ce soit souvent le cas). La sous-unité 8 n'a été trouvée pour l'instant que dans le
poulet bien que sa position phylogénétique implique son existence chez tous les amniotes
(voir chapitre 9). Elle pourrait avoir disparu précocement dans la lignée mammalienne.
Chaque sous-unité du nAChR suit le même schéma d'organisation transmembranaire. Une
large partie amino-terminale, portant les composants du site de liaison, fait face à
l'environnement extracellulaire. Elle est suivie par trois segments transmembranaires, le
second, au moins, étant en hélice , puis un large domaine intracellulaire et un quatrième
segment transmembranaire [Figure 7.1]. La partie carboxy-terminale, assez courte, est donc
extracellulaire. Chez l'humain, la taille des sous-unités varie de 457 résidus ( 1) à
627 résidus ( 4).
L'identité globale de séquence entre les gènes paralogues (apparus par duplication) varie de
36,3 % ( 7/ 3) à 72,4 % ( 2/ 4). L'identité de séquence entre les gènes orthologues
(apparus par spéciation) d'humain et de rat varie de 82,2 % ( 4) à 93,2 % ( 2). La
conservation de séquence n'est pas uniforme le long de la sous-unité. Le peptide signal amino-
terminal et le milieu de la partie cytoplasmique sont hautement variables, la partie amino-
terminale extracellulaire et les portions de la partie cytoplasmique flanquant le pore sont bien
conservées, et les segments transmembranaires sont très conservés [Figure 7.2].
L'étude phylogénétique des sous-unités du nAChR révèle quelques sous-familles claires
[184,45] (voir Figure 7.3). Ces sous-familles, définies sur la base des séquences protéiques et
de la structure des gènes (positions des introns dans la séquence codante) sont congruentes
avec les groupes définis fonctionnellement (par des caractères biochimiques,
pharmacologiques et anatomiques). Dans les neurones, deux sous-groupes de sous-unités ont
été identifiés. 7 and 8 forment des récepteurs sensibles à l' -bungarotoxine ( -bgt). Ces
récepteurs sont généralement homo-pentamériques mais peuvent également former des
hétéro-pentamères. Au contraire, les récepteurs contenant 2- 6 et 2- 4 ne sont pas
sensibles à l' -bgt [32,290,129] et forment toujours des hétéro-pentamères. La première
duplication entre les gènes de sous-unité du nAChR date probablement de plus de 1,5 milliard
d'années, alors que les dernières ont eu lieu il y a environ 400 millions d'années (410 pour
2/ 4, 380 pour 7/ 8). La phylogenèse des récepteurs nicotiniques sera abordée plus en
détail au chapitre 9.
Figure 7.3 : Phylogenèse des sous-unités de la superfamille nicotinicoïde des LGIC. Cet arbre
a été obtenu par les méthodes décrites au chapitre 8. Seules les sous-unités présentes chez les
amniotes sont représentées.

La localisation chromosomique des gènes humains est la suivante : 2 est situé sur le
chromosome 1, 1, et sur le chromosome 2, 2 et 3 sur le chromosome 8, 3,
5 et 4 sur le chromosome 15, 1 sur le chromosome 17 et 4 sur le chromosome
20 (revue dans [6,26] pour les rongeurs). et forment un cluster [151]. 3, 5 et 4
sont également localisés dans un cluster (conservé chez le poulet, le rat et l'homme).
Cependant la régulation de chaque gène semble spécifique (bien qu' 3 et 4 soient
souvent coexprimées, voir le chapitre 12, et puissent partager certains éléments de régulation
transcriptionnelle).
L'analyse des promoteurs des gènes de sous-unité des nAChRs neuronaux est une discipline
naissante. Des éléments de spécificité cellulaire et des activateurs ont été identifiés dans les
promoteurs d' 3 [213,361,110], d' 4 [340], d' 7 [210], de 2 [25,24] et de 3 [155]. Une
analyse fine a été menée à propos du promoteur de la sous-unité 2. Cette étude a mis en
évidence à la fois des éléments activateurs et des éléments inhibiteurs [25]. Parmi ceux-ci, un
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
1
/
17
100%