VIII- Déficits immunitaires combinés: immunités cellulaires

DUVAL Ellie
MARREC Louise
24/03/2011
EC immunodep, immunité acquise et déficits immunitaires, A. Faili
Le prof n'a pas traité le diaporama en entier, les diapos non traitées sont signalées dans ce cours.
Le diaporama sera disponible à la corpo.
IMMUNITE ACQUISE ET EXPLORATION
DES DEFICITS IMMUNITAIRES.
I- Introduction:
Dans l'antiquité l'espérance de vie de l'Homme était de 23 ans. Aujourd'hui en France, elle est d'environ
84 ans.
Comment sommes-nous passés de 23 à 84 ans ?
-grâce à une diminution de la mortalité infantile.
-grâce à la microbiologie et l'immunologie (lutte contre les maladies infectieuses).
L'immunologie est la science de défense de l'organisme contre les agents pathogènes. Cette discipline a
permis le développement des vaccins et des médicaments.
C'est un problème de santé publique: ¼ des français souffre d'une maladie du système immunitaire (SI).
Ex: Allergies, MAI.
A- Quand le SI se met-il en route ?
Quand il rencontre un agent infectieux (bactérie, virus, parasite, champignon, cellule tumorale).
Lutte contre les pathogènes:
par les ATB mais il faut toujours trouver de nouvelles classes chimiques pour empêcher le
développement de résistances.
par les anti-viraux qui agissent en perturbant le cycle de la réplication virale. Cependant, ils ont des
effets néfastes car ils perturbent le fonctionnement cellulaire et développent des résistances.
Nous devons donc compter sur un système immunitaire efficace.
Devant une infection:
Une réponse correcte: le sujet est immunisé et guéri.
Une absence de réponse: infection récurrente.
Une réponse correcte mal ciblée.
B- Inconvénients du SI:
Réponse contre les substances inoffensives (pollen...) : allergies.
Réponse contre les greffons. Conséquences: rejet de greffes.
Réactions contre nos propres constituants et perte de tolérance: auto-immunité.
Perte immunité anti-tumorale: développement cancer.

C- Ce système de défense est divisé en trois parties:
ante-immunité
immunité innée ou naturelle ou non spécifique
immunité spécifique ou adaptative ou acquise à un Ag spécifique.
D- Ces étapes ont plusieurs partenaires:
Barrières: -physiques
-chimiques et biochimiques
-microbiologiques
ex: peau, acidité gastro-intestinale, muqueuses, voies respiratoires et uro-génitales.
Acteurs: les cellules (LB, LT, NK, DC, mastocytes, phagocytes, neutrophiles, macrophages)
Molécules: complément, cytokines, Ac
L'immunologie, c'est mettre ces partenaires ensemble et regarder comment ils interagissent entre eux pour
nous protéger.
II- Ante-immunité:
C'est la première ligne de défense de l'organisme. Elle protège à 99,9% des infections.
-Barrière mécanique:
-peau
-cellules épithéliales
-flux d'air et de liquides (toux, éternuement, flux urinaire, mouvement des cils au niveau des
poumons).
Remarque: les particules sont éjectées à la vitesse de 800km/H lors d'un éternuement.
-Barrière chimique, biochimique:
-les acides gras des glandes sébacées.
-les lysosomes dans la salive.
-NaCl dans la sueur.
-peptides anti-bactériens.
-pepsine de l'estomac.
-Barrière microbiologiques:
Exemple de symbiose
La flore bactérienne du TD est indispensable à la digestion des aliments.
Les cellules épithéliales du vagin produisent du glycogène qui nourrit le lactobacilus qui maintient en
réponse l'acidité vaginale (pH 3) et empêche ainsi l'installation de bactéries et de champignons.
NB:
L'être humain est composé de 1012 cellules qui cohabitent avec 1014 bactéries !
Il y a autant de bactéries dans la salive que dans les matières fécales (100 millions par gramme).
Si la barrière ante-immunitaire est franchie, il y a mise en route d'une deuxième ligne de défense.

III- Immunité innée associée à l'inflammation
L'inflammation n'est pas néfaste. Elle permet aux facteurs de l'immunité innée d'accéder à la zone lésée.
L'induction d'une réponse inflammatoire nécessite la reconnaissance pathogène/cellules du SI.
A- Reconnaissance:
Elle se fait entre des motifs moléculaires très conservés chez les pathogènes (GP, polysaccharide) et des
récepteurs à ces motifs sur les cellules du SI.
PRR = Pathern Recognition Receptor. Ils sont sur les cellules du SI.
PAMPs = Pathogen Associated Molecular Patterns. Ce sont les motifs du non soi. Ils sont présents au
niveau des micro-organismes pathogènes ou non.
Pour déclencher l'inflammation, il faut une interaction entre PRR/PAMPs.
B- Activation du SI
La DC rencontre le pathogène, il y a synthèse de cytokines inflammatoires. La DC phagocyte le
pathogène et présente le peptide antigénique aux LT CD4 par le CMH II. Les LT activés prolifèrent et
s'orientent vers Th1 ou Th2 grâce aux cytokines synthétisées.
Le Th2 synthétise IL4 pour la production d'Ac de haute affinité par le LB.
Le Th1 synthétise IFN γ qui active les CTL.
C- Les PRRs
Sont des groupes de récepteurs dont les gènes ne sont pas polymorphes, ce sont tous les mêmes au sein
d'une espèce.
Ils sont exprimés sur différentes cellules: macrophages, DC, NK, lymphocytes et PN et aussi sur les
cellules résidentes: fibroblastes, cellules musculaires, cellules épithéliales.
Trois types suivants la localisation:
1- PRR solubles ou sécrétés dans les fluides corporels.
Rôle important dans la phagocytose, l'activation du complément, et la réaction inflammatoire. Le plus
souvent ce sont des opsonines dont les composants mènent à l'activation du complément.
-protéines MBP (mannan-binding-protein) ou MBL.
-protéines CRP.
-protéines LBP (LPS-binding-protein).
Le complément est un système de vingt protéines qui réagissent en cascade. Certaines sont des
zymogènes (protéines circulantes) activés par clivage protéolytique. Son but est d'activer la réponse
inflammatoire et de détruire la membrane du pathogène grâce au complexe d'attaque membranaire formé.
2- PRR membranaires à la surface des cellules.
Ils sont impliqués dans la phagocytose, l'activation de la réponse inflammatoire et anti-virale. Ils sont
beaucoup plus diversifiés.

Parmi eux on trouve:
-les R MMR
-les R aux lectines
-les R du complément
-les R Scavengers (phagocytose)
Ces récepteurs ne sont présents que sur les DC et les macrophages.
-famille des TLR
Les TLR se trouvent partout même sur les cellules endothéliales. Les TLR ont un rôle dans la réponse
immunitaire innée, la phagocytose, la réponse inflammatoire et la reconnaissance couplée des parasites,
bactéries et virus.
Il y a deux groupes de TLR
a- TLR 1, 2, 4, 5, 6:
Sur les membranes plasmiques pour la reconnaissance de la paroi des agents infectieux.
Ex: TLR 4 reconnaît le LPS.
TLR 5 reconnaît la flagelline.
TLR1, 2, 6 reconnaissent le PG, les lipoprotéines et les glycophospholipides.
b- TLR 3, 7, 8, 9:
Sur les endosomes pour la reconnaissance des composants viraux et bactériens (surtout les acides
nucléiques).
Ex: TLR 3 reconnaît ARN double brin viral.
TLR 7 et 8 reconnaissent l'ARN simple brin viral.
3- PRR cytoplasmiques ou de signalisation dans le cytoplasme.
Reconnaissance des composants bactériens et viraux intracellulaires.
-NLR: Nod Like Receptor. En intracellulaire. C'est une famille de vingt protéines qui reconnaît
presque exclusivement les composants bactériens.
-RLR: Rig Like Receptor. Reconnaissance essentiellement des composants viraux (Nf κβ).
D- Les PAMPs
Molécules du non-soi qui se trouvent sur les pathogènes. Ces motifs microbiens ont été conservés au
cours de l'évolution. Ils peuvent être de nature lipidique ou protéique.
Ex: Gram + : acide téichoïque et lipotéichoïque.
Gram - : LPS
Si l'immunité innée n'arrive pas à neutraliser les pathogènes, on va déclencher la dernière ligne de défense
de l'organisme.

IV- Immunité acquise
Elle a deux composantes:
-Immunité humorale: LB.
Immunité antibactérienne, synthèse d'Ac.
-Immunité cellulaire: LT
Réponse anti-virale.
L'immunité acquise est impliquée dans la vaccination, la mémoire immunitaire, l'hypersensibilité,
l'allergie, les MAI, le rejet de greffe, les défenses anti-tumorales...
Les cellules du SI sont toutes formées à partir de la CSH ( CD34 + )
Deux lignées:
-lymphoïde: LB, LT, NK
-myéloïde: monocytes, éosinophiles...
A- Les LB
Leur maturation a lieu dans la moelle osseuse.
La formation du BCR nécessite des réarrangement:
-VJ pour la chaîne légère
-VDJ pour la chaîne lourde.
Les Ac sont des glycoprotéines composées de 2 chaînes lourdes identiques reliées par des pont di-sulfures
à 2 chaînes légères identiques.
La partie variable de l'Ac est le fruit des réarrangements géniques.
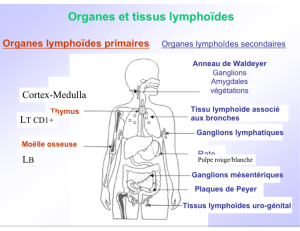
Les LB formés dans la moelle osseuse, rejoignent les OLS par la circulation sanguine. Ils y restent et
attendent d'être activés par l'Ag.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%