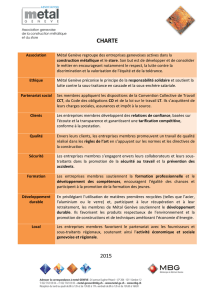
Propriétés chimiques, électrochimiques et biologiques des

Faculté de Médecine de Tizi-Ouzou. Cours de Biomatériaux-2eme année / 2007-2008.
Département de Chirurgie Dentaire.
Propriétés chimiques et électrochimiques
des biomatériaux métalliques.
I- Introduction:
Les propriétés chimiques et électrochimiques des biomatériaux métalliques sont d’une grande
importance, puisque tant au laboratoire qu’en clinique ces biomatériaux sont susceptibles de
présenter différentes forme d’altérations.
Schématiquement, il existe deux types d’altérations :
En atmosphère sèche, nous parlerons des “corrosions simples”.
En atmosphère humide, on a présence d'un électrolyte, nous parlerons de “corrosions
électrochimique”.
Remarque :
Le terme corrosion désigne:
Le processus d'interaction métal/milieu ambiant.
La destruction partielle ou totale du matériau métallique.
II. Corrosion chimique :
Le métal est susceptible de réagir lorsqu’il est directement en contact avec un gaz.
Exemple :
Fe + O2 (à haute température)
La sulfuration de l’Ag (dans l’air polluée par les composées sulfureux)
La sulfuration d’alliages dentaires (chauffés en atmosphère réductrice)
A- Définition de l’oxydation :
Au sens étroit, l’oxydation est la fixation d’oxygène, le phénomène inverse (enlèvement d’oxygène)
étant la réduction.
Au sens large, l’oxydation correspond à la fixation d’un élément électronégatif (oxygène, halogène,
soufre, azote…) ou à l’enlèvement d’un élément électropositif (hydrogène ou métal).
Au sens atomique, l’oxydation est une dé-électronation, c'est-à-dire la perte d’électrons par un atome
ou un groupe d’atomes, le gain d’électrons constituant la réduction.
B- Formation de la pellicule d’oxydation :
Exemple : CuO
Lorsque le “Cu” est chauffé à une température (500-800 c°), les molécules d'O2 sont absorbées à la
surface sous l'action des attractions exercées par les atomes superficiels (on a la rupture des
molécules d'O2 qui vont s'adjoindre aux atomes de Cu) il se forme à la surface une 1ère pellicule mono
moléculaire d'oxyde cuivreux Cu2O de couleur rouge vif, puis d'oxyde cuivrique CuO de couleur noir.
Une fois la première pellicule formée, plusieurs mécanismes sont possibles :
a- Type P :
La croissance peut se faire à l'interphase métal/oxyde pour les oxydes semi-conducteurs de type “P”
telle que : Cu2, NiO, FeO, CoO, Cr2O3

Faculté de Médecine de Tizi-Ouzou. Cours de Biomatériaux-2eme année / 2007-2008.
Département de Chirurgie Dentaire.
b- Type N :
La croissance de la pellicule peut également se faire à l'interphase oxyde/air pour les semi-
conducteurs de type “N” : ZnO, CdO, TiO2 .
Le ZnO ; produit de base de la plupart des biomatériaux d'obturation et de scellement minéraux ou
organique
c- Type bilatéral :
Cette croissance peut se faire bilatéralement et simultanément en son épaisseur : métal / oxyde / Air.
C- Classification des pellicules d’oxydation:
Elle est liée à la diffusion de la couche d'oxydation, vue le rôle important de la pellicule d'oxydation
dans le mécanisme et l'évolution de la corrosion, on a pu constater 2 possibilités :
La diffusion du métal ou de l'O2 à travers la pellicule d'oxyde formée est impossible ou très
lente parce que le volume atomique de l'oxyde est supérieur à celui du métal.
Exemple : Al, Sn, Cu, Fe, Mn, Cr.
La diffusion du métal ou de l' O2 est possible à travers la couche d'oxyde parce que le volume
atomique de l'oxyde est inférieur à celui du métal
Exemple : Na, Ba, Ca, K, Mg.
Dans le premier cas la pellicule aura le rôle protecteur et sera susceptible d'arrêter la corrosion, alors
que dans le second cas elle évoluera de façon plus ou moins continue. En pratique, les pellicules
protectrices peuvent être épaisses visibles ou minces invisibles.
Remarque :
Pour les alliages précieux, comme les alliages contenant d’or, de platine, ou d’argent par exemple,
afin d'améliorer leurs propriétés mécaniques, le “Cu” contenu dans l’alliage peut, suite à un chauffage
s'oxyder en surface, diffuser à travers la couche d'oxyde, ce qui nous donne une coloration
disgracieuse (qui manque totalement de charme). Afin d'éviter un tel déboire, il est préférable de
chauffer l'alliage d'or soi à l’abri de l’air (en présence d'un gaz neutre, en milieu réducteur ou encore
en faisant le vide) soit dans un bain de sel, soit enfin on les protégeant par un flux (acide borique).
Si le métal à été oxydé en surface on pourra éliminer la pellicule d'oxydation formée en la dissolvant
par un acide (H2SO4 à 10%) c’est le décapage.
III- Corrosion électrochimique (endobuccale) :
L'interaction métal-salive engendre des micro-courants entraînant l'altération partiel du matériau
métallique, ainsi que des manifestations pathologiques buccales, cette interaction peut se produire
entre :
Deux couronnes métalliques séparées par la salive qui sert d'électrolyte, les couronnes
conçues en alliages différents. C’est la macro pile.
Au sein d'une même couronne, ou d'une même reconstitution lorsqu'il y a un défaut cristallin
en surface. C’est la micro pile.

Faculté de Médecine de Tizi-Ouzou. Cours de Biomatériaux-2eme année / 2007-2008.
Département de Chirurgie Dentaire.
A- Macro pile:
Deux couronnes métalliques séparées par la salive qui sert d'électrolyte, les couronnes conçues en
alliages différents.
Exemple :
Une couronne en alliage d'or et l'autre en alliage de nickel-chrome
Entre une couronne et une reconstruction métallique
Dans ce cas nous pouvons dire qu'il y a passage d'un courant galvanique; à ce moment, les ions se
déplacent vers le métal le plus noble et les électrons vont vers le métal le moins noble, on réalise se
que l'on appelle une “macro pile”.
B- Micro pile :
Au sein d'une même couronne, ou d'une même reconstitution lorsqu'il y a un défaut cristallin en
surface.
Exemple : Piqûre de surface au niveau d’une couronne en or.
Les ions cuivre vont se déplacer vers la surface de l'alliage d'Or et entraîne une coloration de la
couronne (ternissement local rouge et puis elle s'étend) on a alors une “micro pile”.
C- Conditions :
Pour que ces phénomènes micro et macro pile puissent se produire il faut:
a- réaction d'oxydation :
Que le potentiel de la réaction d'oxydation soit plus négatif que le potentiel de la réaction de réduction
conjuguée car tout métal solide peut être considérer comme un ensemble d'atomes-ions et
d'électrons, lorsque le métal entre en contact avec l'électrolyte, les atomes-ions pourront passer en
solution sous forme d'ions hydratés à condition que l'énergie libérée soit plus grande que l'énergie
nécessaire pour rompre la liaison atomes-ions électrons.
Cependant deux phénomènes peuvent se produire:
si les forces d'hydratation sont insuffisantes pour rompre la liaison atome-ion-électron, dans
ce cas une quantité de cathions de la solution pourra être absorbée par la surface métallique
et constituer la couche la plus interne positive. La couche externe étant constituée par les
anions excédentaires de la solution. Exemple:cas de l'or et du platine.
s'il y a absorption d'un gaz dissous dans l'électrolyte (O2 par exemple),dans ce cas il n'y aura
pas de départ d'ions du métal ni absorption de cathions de la solution.
b- Surface de séparation :
Il faut que la surface de séparation métal-électrolyte présente une hétérogénéité électrochimique ou
ont lieu respectivement les réactions de dissolution du métal et les réactions d'assimilation des
électrons excédentaires par les cations de la solution.

Faculté de Médecine de Tizi-Ouzou. Cours de Biomatériaux-2eme année / 2007-2008.
Département de Chirurgie Dentaire.
C- Facteurs de variation des potentiels d'électrode selon Portevin et Chamdron :
a- Les facteurs internes :
1. Selon la nature du métal :
Le platine (=Pt) et le lithium (=Li) présente une DDP de 4 volt
2. Selon la structure :
La corrosion se réalise le long des grains cristallographiques, elle sera intense lorsque le grain est
gros.
3. Selon l'état de surface :
En fonction du degré de polissage et de la propreté de la surface
4. Selon les couches protectrices :
Les couches protectrices diminuent la valeur du potentiel de quelque dixièmes du volte à 1 volt
5. Déformations et tensions mécaniques :
Les déformations et les tensions mécaniques diminuent le potentiel des électrodes. (Toute variation
de courbure, angle vif, sillon peuvent engendrés les couples galvanique).
6. La fatigue :
Les tensions alternées peuvent provoquées le phénomène de fatigue, il sera accentué lorsque le
milieu est corrosif.
b- Les facteurs externes :
Facteurs chimiques :
“PH” des solutions d'électrolytes, la corrosion est élevée en milieu acide, faible en milieu
neutre, elle est stable en milieu basique
Oxydants, ce sont la température, la concentration de la solution et la durée d’exposition.
IV- Effet de la corrosion :
A- Effet chimique :
Le ternissement de la surface est le 1er signe de l'oxydation
B- Effet physio mécanique :
La corrosion peut être lente et uniforme ou généralisée, elle peut-être localisée sous forme de plaque
ou de piqûre, la corrosion inter cristalline se situe en profondeur et suit le trajet des joins de grain.
La corrosion peut enfin être sélective et ne concerne qu'un seul constituant de l’alliage.
1
/
4
100%