CHIMIE TP 11 - Combustion d`un métal

CHIMIE - TP 11 : Combustion d’un métal Page 1 sur 3
A l’état compact, la plupart des métaux peuvent subir une lente oxydation au contact de l’air mais ne
se consument pas. La réaction d’oxydation a donc lieu mais elle est trop lente pour parler de
combustion. On parle alors de corrosion. C’est donc la vitesse de réaction qui fait la distinction entre
les deux phénomènes.
Il existe plusieurs moyens d’augmenter cette vitesse de réaction :
- Augmenter la surface de contact entre les réactifs
- Augmenter la concentration des réactifs
Les manipulations suivantes auront pour but de vérifier l’influence de ces paramètres sur la vitesse
d’oxydation d’un métal.
Influence de la surface de contact entre les réactifs
Quand un métal est réduit en fines particules, sa surface de contact avec l’air ambiant est bien plus
élevée que pour un bloc compact de même masse. La vitesse d’oxydation au contact de l’air devrait
donc augmenter. Il devrait donc y avoir une taille de particules pour laquelle les métaux deviennent
combustibles.
Influence de la concentration des réactifs
La concentration du dioxygène dans l’air est d’environ 20% et nous savons qu’un métal à l’état
compact ne se consume pas dans l’air. Cependant, si la concentration de dioxygène est plus élevée,
l’oxydation sera plus rapide. Il existe peut-être une concentration de dioxygène dans l’air capable de
rendre un métal combustible.
La combustion
Une combustion est une réaction d’oxydation rapide au cours de laquelle un corps réagit
avec un comburant en dégageant une importante quantité de chaleur par unité de temps.
Préparation du dioxygène pour travail sous atmosphère modifiée
En présence d’ions carbonates, le peroxyde d’hydrogène (Eau oxygénée, H2O2) se décompose par la
réaction par la réaction suivante :
2 H2O2 (l) → 2 H2O (l) + O2 (g)
Cette réaction a lieu naturellement dans l’eau oxygénée, mais à vitesse assez lente. La présence
d’ions carbonates ne fait que l’accélérer mais n’intervient pas dans le bilan réactionnel. Il s’agit donc
d’un cas de catalyse, un autre moyen d’augmenter une vitesse de réaction.

CHIMIE - TP 11 : Combustion d’un métal Page 2 sur 3
Manipulation
Matériel
Zn en poudre
Cu en poudre
Spatule métallique
Bec Bunsen
1 Erlenmeyer de 500 ml en pyrex
2 Bouchons en liège trop grands pour l’erlenmeyer utilisé
Du fil de fer non galvanisé
Une pince coupante
H2O2 à 30 volumes
Na2CO3 en poudre
Un peu de laine de fer
Manipulation 1
Allumer le bec bunsen
Prélever une pointe de spatule de Zn en poudre et la passer dans la flamme
Noter vos observations
Prélevé une pointe de spatule de Cu en poudre et la passer dans la flamme
Noter vos observations

CHIMIE - TP 11 : Combustion d’un métal Page 3 sur 3
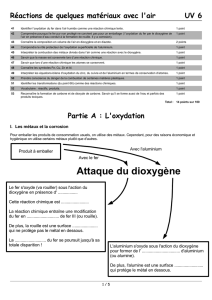
Manipulation 2
Étape 1 : Préparation d’un milieu riche en dioxygène
Placer 10 ml d’eau oxygénée dans l’erlenmeyer
Ajouter 10 ml d’eau du robinet
Ajouter 2 cuillères à café de carbonate de sodium
Poser le bouchon en liège sur l’ouverture sans l’enfoncer
Observer le dégagement gazeux dans l’erlenmeyer. S’il semble trop fort, rajouter un peu
d’eau.
Étape 2 : Combustion
Planter un bout de fil de fer de 10 cm dans le second bouchon et tordre son extrémité
pour en faire un crochet
Accrocher à votre crochet un peu de laine de fer
Initier une incandescence sur la laine de fer en passant l’extrémité de votre montage
dans la flamme d’un bec bunsen
Retirer votre premier bouchon de l’ouverture de l’erlenmeyer et le remplacer par votre
montage de sorte à fer pendre le fil et la laine de fer dans le récipient.
Noter vos observations
Résultats
Qu’observe-t-on lors de la première manipulation ? Que peut-on en conclure ?
Qu’observe-t-on lors de la deuxième manipulation ? Que peut-on en conclure ?
1
/
3
100%