Unit A, Lesson 1 - Holy Trinity Academy

Les Réactifs Limitants et en Excès
On appelle les coéfficients dans une réaction équilibrée des coéfficients
stoechiométriques car on les utlise dans des calculs stoechiométrique.
Si les réactifs sont présents dans des montants qui correspondent aux rapports
molaires, ils sont présents en montants stoechiométriques.
Quand les réactifs sont en montants stoechiométriques, aucune trace des réactifs sera
laissée à la fin de la réaction.
Dans la plupart des réactions, un réactif est épuisé avant l’autre. Le résultat est qu’un
ou plusieurs réactifs sont laissés sans avoir complètement réagit.
Dans ces cas, le montant de produit est limité par le réactif qui est consommé en
premier.
Le réactif qui est complètement consommé s’aappelle le réactif limitant.
Des réactifs qui restent s’appellent des réactifs en excès.
Le réactif limitant ne doit pas être celui present avec moins de moles. Par contre, il est
le réactif qui formera moins de moles de produit.
Par exemple, dans une réaction entre 1,5 mol d’ydrogène et 1,0 mol d’oxygène pour
produire de l’eau
2 H2(g) + O2(g) → 2 H2O(l)
On trouvera que l’hydrogène est utlisé en premier, créant un maximum de 1,5 mol
d’eau.
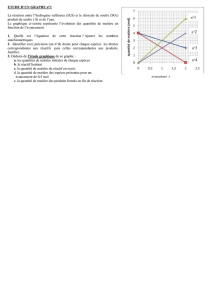
Pour identifier le réactif limitant, to dois avoir une réaction équilibrée et tu dois avoir
calculé le nombre de moles de chaque réactif. Utilisez ces montants afin de calculer le
montant maximum de produit qi peut être crée.
EX: Un morceau de magnesium de 1,25 g est mis dans 80,0 mL d’acide
chlorhydrique à 0,113 mol/L. Quel réactif est le réactif limitant? Quel montant de
réactif en excès va rester à la fin de la réaction?
EX: Calcule la masse de précipité qui devrait être produit quand 200 mL de sulfate
de fer(II) à 0,118 mol/L est mélange avec 175 mL de phosphate d’ammonium à 0,204
mol/L.

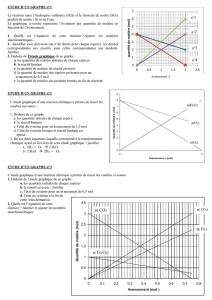
Chimie 20 Réactif Limitant
1. Quel serait le réactif limitant, si 100,0 mL d'une solution de 0,5 mol/L de nitrate
de magnésium a été mélangé avec 125,0 mL d'une solution de phosphate de
sodium mole de 0,8 mol/L? Calculer la masse attendue de précipité dans cette
réaction
.
2. Est-ce que 600 mL de 0,085 mol/L de sulfure de sodium serait suffisante pour
éliminer tout les ions de mercure(II) dans 200 ml de 0,221mol/L HgCl2 (aq)?
Expliquez votre réponse.
3. Quel volume de gaz hydrogène sera produit à TAPN lorsque 2,00 g de
magnésium réagit avec 300 ml de 0,105 mol / L d'acide iodhydrique?
4. Calculez le montant maximum de sulfate de molybdène qui peut être produite par
une réaction de formation alors que 50 g de molybdène, 50 g de soufre et 50 g
d'oxygène réagissent ensemble.
5. Déterminer la concentration d’ions de cuivre (II) restant en solution après la
réaction entre 400 mL de 0,300 mol / L de nitrate de cuivre (II) et de 150 mL de
0,150 mol / L d'hydroxyde de sodium.
1
/
2
100%