Chapitres 1 et 2 de Chimie

Chapitre 01 de Chimie
Transformations lentes ou rapides
La cinétique chimique est l’étude de l’influence du paramètre « temps » sur l’évolution des
transformations chimiques.
Pour toutes les transformations chimiques, deux facteurs jouent un rôle prépondérant :
-La température
-Les concentrations d’un/des réactifs
La cinétique de la réaction est d’autant plus rapide que la température est élevée mais l’état final
reste le même.
La cinétique de la réaction est d’autant plus rapide que la concentration de réactif en excès est
importante mais l’état final reste le même.
Tous les facteurs cinétiques augmentent la densité de probabilité de rencontre des réactifs par
unité de temps.
Chapitre 02 de Chimie
Suivi temporel d’une transformation chimique. Vitesse de réaction
Méthode chimique d’analyse :
Pour suivre l’évolution temporelle d’une transformation chimique lente, on réalise le titrage d’un
réactif qui disparaît ou d’un produit formé.
La réaction de titrage est une méthode lente et qui pose problème car la réaction ne s’arrête pas.
On réalise donc une trempe à l’instant t choisi afin de bloque la réaction en agissant sur un facteur
cinétique ( Diminution de la température en plongeant la réaction dans un bain de glace)
Méthodes Physiques d’analyse :
1. Conductimétrie : Mesure de la conductivité de la solution permettant d’accéder à la
concentration des ions
2. pH-métrie : Mesure du pH lors de l’apparition/disparition des ions H+ pour accéder à la
concentration des différentes espèces présentes en solution
3. Echelle des teintes/Spectrophotométrie : Lorsque la transformation met en jeu des espèces
colorées, on compare la couleur de mélange réactionnel à l’echelle de teintes. On peut ainsi en
déduire l’ordre de grandeur et la concentration recherchée.
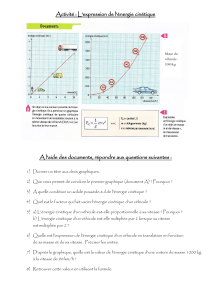
La vitesse volumique de réaction, exprimée en quantité de matière par unité de temps et de volume
est définie dans le système internationnal par : v(t) = 1/V * dx/dt
Avec v en mol.L-1.s-1, V en L, dx en mol et dt en s.
La vitesse de réaction est proportionnelle à la valeur du coefficient directeur de la tangente.
Lorsque la concentration du réactif limitant augmente, on a un effet cinétique, et l’état final est
modifié.
Le temps de demi-réaction correspond au temps nécéssaire pour qu’il y ait disparition de la moitié
de la quantité de matière du réactif limitant.
1
/
1
100%