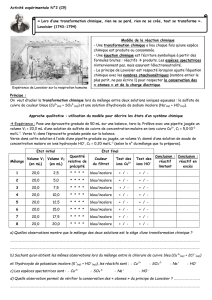
Chapitre 3

Enveloppe du Bâtiment Page 1
Chapitre 3 Sciences Physiques - BTS
La réaction chimique
1. Les équations bilans
1.1. Noms et symboles
Une réaction chimique peut être considérée comme une réorganisation de la matière.
On distingue les « réactifs » des « produits de la réaction »
On écrit l’équation bilan qui ne donne aucune information sur la façon dont se déroule la
réaction.
Réactif 1 + Réactif 2 + Réactif 3 + …. = Produit 1 + Produit 2 + produit 3 …
ou
Réactif 1 + Réactif 2 + Réactif 3 + …. Produit 1 + Produit 2 + produit 3 …
1.2. Equilibrer une équation bilan
Equilibrer une équation bilan demande l’application successive de deux lois de conservations :
La loi de conservation des éléments chimiques : chaque élément chimique doit se trouver en
nombre identique des 2 côtés de l’équation.
« Rien ne se perd, rien ne se crée, tout se transforme »
Antoine Laurent de Lavoisier (1743 – 1794)
La loi de conservation de la charge électrique
1.3. Exemples
Le propane gazeux régit avec le dioxygène de l’air pour donner du gaz carbonique et de l’eau
…………………………………………………………………………………………………………………………………………………
L’ion Fe2+ réagit avec l’élément Aluminium pour donner l’élément Fer et des ions Aluminium
…………………………………………………………………………………………………………………………………………………
La réaction entre le permanganate de potassium et une solution de fer
…MnO4- + …H+ + …Fe2+ → …Mn2+ + …H2O + …Fe3+

Enveloppe du Bâtiment Page 2
2. Quelques familles de réactions
2.1. Les réactions de combustion
La combustion est une réaction chimique exothermique qui ne peut
se produire que si l’on réunit trois éléments : un combustible, un
comburant et une énergie d’activation en proportion suffisante . On
représente de façon symbolique cette association par le triangle du feu.
Le combustible peut être un gaz ( butane, propane, gaz de ville,
dihydrogène …), un liquide (essence, gasoil, huile, kérosène …), un
solide (bois, papier …)
Le comburant est l’autre réactif de la réaction chimique.
La plupart du temps, il s’agit de l’air ambiant et plus
particulièrement le dioxygène mais il peut s’agir d’autre
composés comme le dichlore Cl2
Combustion complète du méthane dans le dioxygène :
…………………………………………………………………………………………………
Combustion du fer dans le dichlore : … Fe(s) + … Cl2(g) = … FeCl3(s)
2.2. Les réactions d’addition
L’addition est une réaction au cours de laquelle plusieurs molécules « fusionnent » pour n’en donner
qu’une seule. Ces réactions ont lieu en particulier sur les alcènes comportant des doubles liaisons
carbone et on parle de « l’ouverture de la double liaison »
addition du dihydrogène sur l’éthène (l’éthylène) : C2H4(g) + H2 = C2H6
Réaction d’hydrogénation :

Enveloppe du Bâtiment Page 3
addition du dichlore sur l’ethylène : C2H4 + Cl2 C2H4Cl2 (dichloro -1, 2éthane)
addition de l’eau sur l’ethylène : C2H4 + H2O C2H6O (éthanol)
Réaction d’hydratation :

Enveloppe du Bâtiment Page 4
2.3. Les réactions d’élimination
On peut considérer que l’élimination est une réaction au cours de laquelle une double liaison
carbone : C=C est formée tandis qu’une petite molécule est libérée.
élimination d’eau d’une molécule de butanol C4H10O : réaction de déshydratation.
C4H10O(l) H2O(l) + C4H8(l)
2.4. Les réactions de substitution
La substitution est une réaction au cours de laquelle un élément d’une molécule est remplacé par
une autre.
substitution du brome par de l’iode sur le bromobutane C4H9Br
C4H9Br + HI HBr + C4H9I
Chloration du méthane : à chaud, entre 350 et 600°C, ou en présence de lumière, on obtient un
mélange de CH3Cl, CH2Cl2, CHCl3 et CCl4
2.5. Les réactions de polyaddition
Les polyadditions sont des réactions au cours desquelles un grand nombre de molécules identiques
s’additionnent les unes aux autres (l’addition a lieu à chaque fois sur une double liaison). L’unique
réactif s’appelle le monomère tandis que le seul produit s’appelle le polymère. Les polymères sont
des macromolécules.
(pollus=plusieurs – meros = partie)
Exemples : polychlorure de vinyle (PVC) ; polyamides,
polyuréthanes, silicones, caoutchouc …
Polymérisation par addition :

Enveloppe du Bâtiment Page 5
Le caoutchouc naturel : un polymère de l’isoprène :
2.6. Les réactions de polycondensation
Les polycondensations sont des réactions d’additions suivies d’élimination de petites molécules
(comme de l’eau).
2.7. Les réactions de précipitation
La précipitation est une réaction au cours de laquelle des anions et des cations s’agglomèrent pour
former un solide ionique que l’on appelle précipité. Les réactions de précipitation sont utilisée dans
la mise en évidence de certains ions : ions sulfates, ions chlorures, ions metalliques …
Mise en évidence des ions ferriques Fe3+ : test à la soude concentrée.
Quelques gouttes de soude concentrée NaOH dans une solution contenant des ions Fe3+ fait
apparaitre un précipité de couleur rouille caractérisant l’ion ferrique :
Fe3+(aq) + 3OH-(aq) = Fe(OH)3(s)
Mise en évidence des ions chlorures Cl- : test au nitrate d’argent.
Quelques gouttes de nitrate d’argent dans une solution contenant des ions chlorures fait apparaitre
un précipité blanc de chlorure d’argent :
Ag+(aq) + Cl-(aq) = AgCl(s)
2.8. Les réactions acido-basiques
Les réactions acido-basiques sont des réactions au cours desquelles il y a échange de prorons H+. Ces
réactions feront l’objet d’une étude ultérieure.
2.9. Les réactions d’oxydoréduction
Ces réactions sont caractérisées par un transfert d’électrons. Ces réactions feront l’objet d’une étude
ultérieure.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%