Chapitre 8 – Temps et évolution chimique : la cinétique des

Etablissement d’une carte mentale puis fiche de synthèse distribuée pour ceux qui n’arrivent
pas à suivre sur une carte mentale.
1. La durée d’une réaction chimique
Une réaction est rapide quand on ne s’aperçoit pas de l’évolution des espèces mises en jeu
(disparition des réactifs ou apparition des produits).
Une réaction est lente quand elle dure de quelques secondes à plusieurs dizaines de minutes.
La cinétique d’une transformation chimique est l’étude de l’évolution dans le temps de cette
transformation : durée de la réaction, évolution de la quantité de matière de réactifs et de
produits.
2. Les paramètres influençant la vitesse d’une transformation chimique = facteurs
cinétiques
TP 14 – Facteurs cinétiques (p 230-231)
Après le TP :
http://goo.gl/forms/3gCgkzCsBV
La concentration : plus la concentration en réactifs est importante plus une réaction est
rapide. Si un réactif est solide, la réaction est plus rapide s’il est en poudre car la surface de
contact est plus grande.
La température : une température élevée accélère une réaction. Certaines réactions ne
s’enclenchent pas si on ne chauffe pas. Si on veut stopper une réaction on la place dans un
bain de glace.
La lumière apporte une énergie supplémentaire et déclenche des réactions. Exples divers :
bronzage, photosynthèse, etc.
Le solvant accélère ou ralentit une réaction, puisque des interactions peuvent exister entre
réactifs et solvants.
Les catalyseurs : homogène, hétérogène et enzymatique
Un catalyseur est une substance qui accélère une réaction sans en modifier le bilan. Il
n’apparaît pas dans l’équation-bilan.
Chapitre 8 – Temps et évolution chimique : la cinétique des
transformations chimiques

Il modifie la nature des étapes permettant de passer des réactifs aux produits : la réaction
globale lente est remplacée par plusieurs
réactions plus rapides.
Un catalyseur est homogène quand il est dans
la même phase que les réactifs, hétérogène
sinon.
Un catalyseur est enzymatique quand il s’agit
d’une enzyme.
Exercice 11 p 245, 20 p 247
En classe: 22 p 248

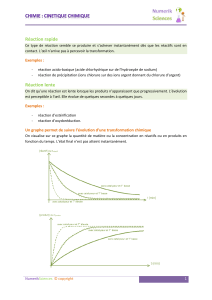
3. Le suivi d’une transformation chimique
Pour suivre l’évolution d’une transformation chimique, on étudiera la variation d’un des
paramètres en fonction du temps : la concentration d’un réactif ou d’un produit, l’avancement
de la réaction, la pression du milieu si des gaz sont présents, etc.
TP 15 – Suivi par spectrométrie
TP en fin d’année avec synthèse, avant le TP :
http://goo.gl/forms/ZRdZRJHlju
Les techniques :
Méthodes chimiques: mesure(s) de concentration(s) par titrage en réalisant des
prélèvements puis des trempes du milieu réactionnel.
Méthodes physiques: spectrophotométrie (mesure d’absorbance d’une substance colorée),
conductimétrie (mesure de la conductivité si le mélange présente des espèces ioniques),
manométrie (mesure de pression si un gaz est présent, par exemple si le dihydrogène est un
produit), la chromatographie sur couche mince pour observer l’évolution de la réaction mais
cela reste qualitatif (on ne peut déterminer la quantité de produits formée).
Lorsqu’on fait une étude cinétique, on recherche
l’avancement final mais aussi le temps de demi-
réaction qui nous donne un indice sur la durée de
la réaction.
Le temps de demi-réaction est la durée
nécessaire pour que la moitié du réactif limitant
soit consommée : x=x max /2 à t=t1/2
On admet alors qu’un système cesse d’évoluer
après quelques t1/2.
A la maison: Exercice 14 p 245, 13 p 245, 18
p 246
En AccPer: 26 p 25, en même temps que
révision oxydoreduction 28 p 252
En classe: 24 p 249


1
/
5
100%