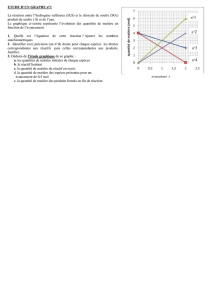
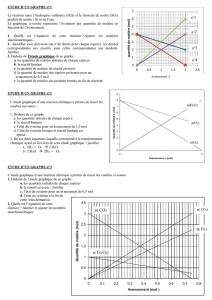
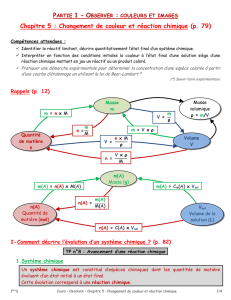
Chapitre 5 : Réaction chimique et bilan de matière

Chapitre 5 : Réaction chimique et bilan de matière
Rappel de seconde : Système chimique, transformation chimique, réaction chimique et
équation chimique
Lors d’une transformation chimique, des entités chimiques, appelés réactifs, sont transformés
en d’autres entités chimiques, appelés produits. A ne pas confondre avec les transformations
physiques. Lors d’une transformation physique, les entités changent justes d’état (liquide,
solide ou gazeux).
Au cours d’une transformation chimique, il se produit des ruptures de liaisons dans les entités.
Il y a alors, au cours de la transformation, réarrangement des atomes et donc formation de
nouvelles entités.
Comme l’a dit Lavoisier « Rien ne se perd, rien ne se crée, tout se transforme ». Il y a donc
conservation du nombre d’atomes de chaque élément présent.
Un système chimique est un mélange d’espèces chimiques.
Pour décrire l’état du système chimique, à un instant donné, il faut indiquer :
- La nature des espèces chimiques ( nom ou formule) et leur état physique (solide
(s) , liquide (l) ou gazeux(g) ou en solution aqueuse (aq)).
- Les quantités de matière des espèces présentes.
- La température T et la pression P.
Lorsque l’évolution du système chimique s’accompagne de l’apparition de nouvelles
espèces on dit que le système subit une transformation chimique.
On doit donc étudier l’évolution du système chimique au cours du temps.
Le chimiste ne s’intéresse qu’à l’état initial et à l’état final du système :
- L’état du système avant toute évolution constitue l’état initial.
- Son état, lorsque toute évolution a cessé, est l’état final.
La transformation chimique est l’évolution du système chimique.
Dans ce chapitre, on ne s’intéressera qu’au bilan de matière : on ne prendra donc en
compte que de l’évolution de la composition du système chimique.

Introduction :
Suite à une transformation chimique, la composition d’un système chimique (ensemble
des espèces chimiques mises en jeu au cours d’une réaction chimique) à l’état final
dépend des quantités de matière introduites à l’état initial.
Objectifs :
Pour déterminer la composition des espèces chimiques lors d’une réaction chimique, il faut :
- Connaître la stœchiométrie d’une réaction chimique
- Savoir définir l’avancement de la réaction
- Déterminer le réactif limitant ou en excès
I) La stœchiométrie d’une réaction chimique
La transformation chimique est modélisée par une réaction chimique (ne rendant compte que
des interactions ayant lieu entre les espèces chimiques), réaction chimique, symbolisée par
une équation chimique.
Dans l’équation chimique, on symbolise les réactifs et les produits par leurs formules
brutes et on indique les proportions dans lesquelles les réactifs sont consommés et les
produits apparaissent. Il s’agit de l’ajustement des nombres stœchiométriques.
Ajuster les nombres stœchiométriques d’une équation, c’est choisir ces nombres de manière à
traduire la conservation de tous les éléments mis en œuvre.
Exemple : On réalise la transformation chimique du sodium solide Na avec le gaz dioxygène
O2 qui conduit à la formation d’un solide, l’oxyde de sodium Na2O, dans des conditions où le
volume molaire est Vm= 24L.mol-1 .
1. Écrire l’équation de la réaction.
II) L’ avancement de la réaction
L’évolution des quantités de matière des réactifs et des produits se calcule à l’aide d’une
grandeur appelée l’avancement, notée x et qui s’exprime en mole.
Par définition, l’avancement d’une réaction chimique est égale à la quantité de matière
apparue d’un produit si son nombre stœchiométrique est 1 dans l’équation chimique.
C’est aussi la quantité de matière disparue d’un réactif si son nombre stœchiométrique
est 1 dans l’équation chimique.
A l’état initial, l’avancement est nul puis augmente jusqu’à atteindre sa valeur maximale xmax
à l’état final.
Lors d’une réaction chimique, les quantités de matière des réactifs consommés sont
proportionnelles aux nombres stœchiométriques figurant dans l’équation chimique.

Pour calculer la quantité de matière consommée ou formée d’une espèce mise en jeu dans la
réaction, on multiplie l’avancement x par le nombre stœchiométrique de cette espèce.
Suite de l’exemple :
2. Compléter les deux premières lignes du tableau d’avancement dans le cas où l’on
introduit 4,6g de sodium et 29L de dioxygène.
Equation de la
réaction
Na(s)
+
O2(g)
Na2O(s)
Etat du
système
Avancement
(mol)
n(Na)
(mol)
n(O2)
(mol)
n(Na2O)
(mol)
Etat initial
0
Etat
intermédiaire
x
Etat final
xmax =
...........
III) Réactif limitant, réactif en excès, mélange stoechiométrique
Si tous les réactifs ont été consommés à l’état final, le mélange de réactifs est dit
stœchiométrique.
Lorsque le mélange des réactifs n’est pas stœchiométrique, un des réactifs a été
totalement consommé alors qu’au moins un des autres est encore présent : le réactif
totalement consommé est appelé réactif limitant. Les autres sont en excès.
Pour déterminer la composition du système chimique à l’état final, il faut déterminer quel est
le réactif limitant. Il faut donc émettre des hypothèses sur l’éventuel réactif limitant.
Suite de l’exemple :
3. a. Quel serait l’avancement maximal en supposant que le réactif limitant est le sodium
Na ?
b. Quel serait l’avancement maximal en supposant que le réactif limitant est le
dioxygène O2 ?
c. Quel est effectivement le réactif limitant et quel est l’avancement maximal ?
4. Préciser la composition de l’état final du système.
5. Quelle est la masse d’oxyde de sodium formée à l’état final ?
Données. Masse molaire : ; .

CORRIGÉ :
1. Les réactifs sont le sodium Na et le dioxygène O2. Le produit de la
transformation est l’oxyde de sodium Na2O.
On ajuste avec des nombres stœchiométriques pour traduire la conservation des
éléments chimiques et des charges. Soit :
2. Sur la première ligne, on écrit l’équation de la réaction et on peut compléter
pour l’état initial qui est connu. Ensuite, on considère que 4x mol de Na réagissent
avec x mol de O2 pour donner 2x mol de Na2O.
3. a. Si le réactif limitant est le sodium Na, alors il est totalement consommé.
Donc , d’où mol.
b. Si le réactif limitant est le dioxygène O2 , alors il est totalement consommé.
Donc , d’où mol.
c. C’est le sodium qui disparaît en premier car l’avancement maximal est le plus
petit. Le sodium est le réactif limitant et mol.
4. Comme mol, alors dans l’état final on a :
mol. Le réactif O2 est en excès.
mol.
Il s’est formé 0,1 mol de Na2O.
5. , d’où avec
.
Donc .
1
/
4
100%