Classe :TD - Année 2014-2015 : - OG5 :

Classe :TD - Année 2014-2015 : - OG5 : - Chap.9 Les amines
1 sur 10
Chimie – Chap.9: Les amines
1 sur 10
Phase d'acquisition
Activités,
questions
Professeur
Activités,
réponses
Apprenants
Trace écrite
Observatio
n
Chapitre 9
Les amines
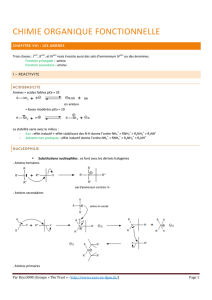
I. L'ammoniac et les amines
1. Structure de l'azote (Rappel)
L'azote est l'élément chimique caractérisé par le coupe (Z=7, A=14). Sa formule
électronique s'écrit:
K2L5
La représentation de Lewis de l'atome d'azote est :
L'atome d'azote est trivalent
2. L'ammoniac
Dans la molécule de l'ammoniac l'atome d'azote entretient trois liaisons
covalentes avec trois atomes d'hydrogène. Sa formule est
N H3
.
3. Les amines
La formule d'une amine aliphatique s'obtient à partir de la formule d'ammoniac
Durée :
1 heure
N

Classe :TD - Année 2014-2015 : - OG5 : - Chap.9 Les amines
2 sur 10
Chimie – Chap.9: Les amines
2 sur 10
en remplaçant un, deux ou trois atomes d'hydrogène par des groupements
alkyles ou aryles
H3C−N H2 ; H3C−CH2−NH−CH3 ; H3C−N(CH3)−C6H5
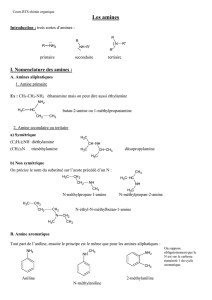
II. les trois classes d'amine
1. les classes
La classe d'une amine dépend du nombre d'atome(s) d'hydrogène remplacé(s) dans la
molécule d'ammoniac. L'amine est dite:
- primaire si un atome d'hydrogène est remplacé,
- secondaire si deux atomes d'hydrogène sont remplacés,
- tertiaire si trois atomes d'hydrogène sont remplacés.
2. Nomenclature radico-fonctionnelle
Le mot amine est précédé du nom des substituants alkyles ou aryles de l'atome
d'azote, énumérés dans l'ordre alphabétique.
Exemples
H3C−N H2 ; H3C−CH2−NH−CH3 ; H3C−N(CH3)−CH3 ; C6H5−NH2
méthylamine éthylméthylamine triméthylamine phénylamine
3.
4. La phénylamine est aussi appelée l'aniline.
5. Nomenclature substitutive
a) amines primaires

Classe :TD - Année 2014-2015 : - OG5 : - Chap.9 Les amines
3 sur 10
Chimie – Chap.9: Les amines
3 sur 10
Le nom d'une amine primaire s'obtient à partir du nom de l'alcane correspondant, en
remplaçant le « e » final par la terminaison « amine », précédée, entre tirets, de
l'indice de position du groupe
−N H2
Exemples :
H3C−NH2 H3C−CH (NH2)−CH2−CH3 H3C−(CH3)C(CH2)−CH2−CH2−NH2
méthanamine butan-2-amine 3,3-diméthylbutan-1-amine
b) amines secondaires et tertiaires
Pour nommer une amine secondaire ou tertiaire, on cherche celui des groupes R1, R2,
R3 qui possède la chaîne carbonée la plus longue et l'on forme, à partir de cette
chaîne, le nom de l'amine primaire correspondant. Les noms des autres groupes
carbonés liés à l'atome d'azote sont mentionnés devant celui de l'amine primaire,
précédés par la lettre N pour indiquer qu'ils sont directement liés à l'atome d'azote.
Exemples:
H3C−NH−CH3 H3C−N(C2H5)−CH2−CH2−CH3
N-méthylméthanamine N-éthyl-N-méthylpropan-1_amine
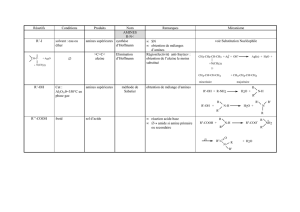
III. Propriétés chimiques des amines
1. Définition des bases
▪ La théorie de Brönsted
La théorie de Brönsted-Lowry a défini :
- l'acide comme une substance capable de céder un proton dans le milieu, et
- la base comme une substance capable de capter un proton.

Classe :TD - Année 2014-2015 : - OG5 : - Chap.9 Les amines
4 sur 10
Chimie – Chap.9: Les amines
4 sur 10
▪ La théorie de Gilbert Lewis
La théorie de Gilbert Lewis définit :
- une base comme un donneur de doublets d'électrons et,
- l'acide (ou adduit de Lewis) comme accepteur de doublets d'électrons.
Les acides sont ainsi des substances qui, combinées avec des bases,
partagent des électrons afin de former des composés de coordination.
▪ Conclusion
La théorie de Brønsted-Lowry est en fait un cas particulier de la théorie de Lewis qui
a une valeur théorique beaucoup plus élevée.
Une base est un produit chimique qui, à l'inverse d'un acide, est capable:
- de capturer un ou plusieurs protons
- ou de fournir des électrons.
Un milieu riche en bases est dit basique
Base dans l'eau
En milieu aqueux, on utilise habituellement la définition de Brønsted-Lowry.
Lorsque la base B est mise en présence d'eau, la réaction suivante a lieu:
B + H2O → BH+ + OH-
La base B capte un proton pour devenir BH+

Classe :TD - Année 2014-2015 : - OG5 : - Chap.9 Les amines
5 sur 10
Chimie – Chap.9: Les amines
5 sur 10
L'ion ammonium
N H4
+
est obtenu par transfert d'un ion d'hydrogène
(protonation) à une molécule d'ammonium
N H3
:
N H3+H2O→N H4
++OH-
2. Action des indicateurs colorés
Couleurs des indicateurs colorés en fonction du pH
Bleu de bromothymol
(BBT)
PH<6,2
jaune
6,2<pH<7,6
vert
pH>7,6
bleu
Phénolphtaléine
pH<8
incolore
8<pH<10
rose
pH>10
violet
Hélianthine
PH<3,1
rouge
3,1<pH<4,4
orange
pH>4,4
jaune
3. Caractère basique
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%