République Algérienne Démocratique et Populaire
Université Larbi Ben M’hidi Oum El Bouaghi
Faculté des Sciences Exactes et Science de la Nature et la Vie
Département des Sciences de la Matière
N° d’ordre :…/2018
MEMOIRE
Pour l’obtention de Master en chimie
Option : Chimie des Matériaux
Présenter par : GHOUL BILAL
Sous la direction de Dr : BOUCHEMMA AHCENE
Soutenu le : 11-06-2018
Devant le jury de soutenance suivant :
Mme SID ASSIA Docteur Univ OEB Présidente
Mr OUCHEMA AHCE Professeure Univ OEB Rapporteur
Mme LAKHEL SALIMA Docteur Univ OEB Examinatrice
Mme ZOUCHONE FAIROUZ Docteur Univ OEB Examinatrice
Année Universitaire : 2017/2018
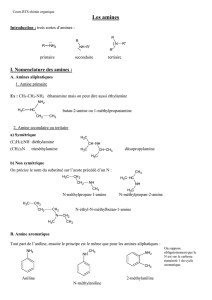
ACTIVITE ET REACTIVITE DES AMINES
ET LEURS APPLICATIONS

Remerciements
Ce travail a été réalisé au niveau de laboratoire de chimie organique de l’université
de Larbi Ben M'hidi Oum El Bouaghi, sous la direction scientifique de professeur
BOUCHEMMA Ahcen.
Nous adressons à monsieur BOUCHEMMA Ahcen, notre profonde gratitude ainsi que notre
reconnaissance, pour ces conseils et ces encouragements avec beaucoup de patience et de
gentillesse, et pour ces orientations tout au long de ce travail.
Mes remerciements s’adressent également à madame SID Assia docteur à l’université
de Larbi Ben M'hidi Oum El Bouaghi, qui me fait j’honneur d’être la présidente de jury de
mon exposition. Je suis également très honorée de la présence, dans ce jury de Madame
LAKHEL Salima et Madame ZOUCHOUNE Fairouze docteures à l’université
de Larbi Ben M'hidi Oum El Bouaghi.
Nous adressons l'expression de notre reconnaissance et de nos remerciements à
Monsieur GOUMIDENE chef de département de la science de la matière à l’université
Oum-El-Bouaghi, pour son aide précieuse et pour la réalisation de ce manuscrit.
Mes remerciements aussi à NACER Abbir la douanée de faculté de science exacte.
Aux Membres du laboratoire : Monsieur BEGHOU Salem pour leurs aide matérielle
(laboratoire du l’université d’Oum El Bouaghi). Ainsi que Madame HADJAM Meriem et
Melle MALKI Souhila (doctorantes l’université d’Oum El Bouaghi) qui sont m’aidé pour
terminer ce travail, Nous adressons à Monsieur RAMOUL Lahcene responsable du magasin
des produits chimique et matérielle pour leur aide.
A Monsieur ABDELAZIZE Redjem chef service de mon travail.
A tous ceux qui nous ont aidé de loin ou de proche pour la réalisation de ce travail.
Merci à toutes et à tous.

Dédicace
Je dédie ce modeste travail à :
L’esprit de mon cher père ;
La lumière de ma vie, ma très chère mère ;
Mes frères, et mes sœurs
Mes collègues, et toutes mes amies

LISTE DES FIGURES
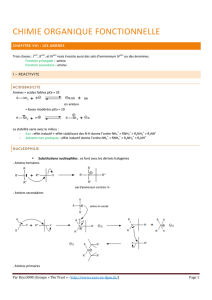
Figure 1 : les amines………………………………………………………………….
4
Figure 2 : Structure de méthylamine………………………………………………….
4
Figure 3 : Les classes des amines organiques………………………………………...
6
Figure 4 : L’appareille de point de fusion…………………………………………….
2
Figure 5 : Spectrométrie d’absorption de l’ultraviolet et du visible………………….
22
Figure 6 : L’appareille d’Infrarouge………………………………………………….
25
Figure 7 : Les germes testés………………………………………………………...
31
Figure 8 : préparation des milieux des cultures………………………………………
31
Figure 9 : préparation des précultures ………………………………………………..
32
Figure 10 : spectre IR de 1, 3,5-triphényl-1, 3,5-triazacyclohexane………………….
35
Figure 11 : spectre RMN 1H de 1,3,5-triphényl-1,3,5-triazacyclohexane……………
36
Figure 12 : spectre RMN13 C de 1,3,5-triphényl-1,3,5-triazacyclohexane…………...
36
Figure 13 : spectre UV-visible de 1, 3,5-triphényl-1, 3,5-triazacyclohexane………...
37
Figure 14 : spectre IR du 1.3.bis (4-chlorophenyl)-5-benzyl-1,3,5-triazinane………..
38
Figure 15 : spectre RMN 1H du1.3.bis (4-chlorophenyl)-5-benzyl-1,3,5-triazinane….
39
Figure 16 : spectre RMN 13 Cdu1.3.bis (4-chlotophenyl)-5-benzyl-1,3,5-triazinane….
40
Figure 17 : spectre UV-visible du 1.3.bis (4-chlotophenyl)-5-benzyl-1,3,5-triazinane.
41
Figure 18 : Spectre IR d’un sel d’aniline……………………………………………..
41
Figure 19 : spectre UV d’un sel d’aniline…………………………………………….
42
Figure 20 : Spectre IR d’un sel de benzyle……………………………...……………
43
Figure 21 : spectre UV d’un sel de benzyle ………………………………………….
44

LISTE DES SCHEMAS
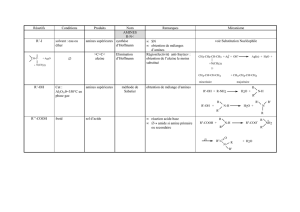
Schéma 1 : Préparation d’une amine primaire………………………………………..
7
Schéma 2 : Réduction du groupement nitro…………………………………………..
7
Schéma 3 : préparation des amines primaires par l’action des cyanures sur les
halogénures d’alkyle………………………………………………………………….
7
Schéma 4 : Préparation d’une amine secondaire……………………………………...
8
Schéma 5 : Réaction de réduction des imines et amides……………………………...
9
Schéma 6 : Préparation d’une amine tertiaire………………………………………...
9
Schéma 7 : Ordre de la basicité des amines…………………………………………..
10
Schéma 8 : La délocalisation des électrons π de l’aniline…………………………….
11
Schéma 9 : Structure d’ion d’ammonium quaternaire………………………………..
11
Schéma 10 : Stabilisation par résonance des amides…………………………………
11
Schéma 11 : Inter conversion des amines…………………………………………….
12
Schéma 12 : Réactivité des amines…………………………………………………...
13
Schéma 13 : Réaction d’imine………………………………………………………..
14
Schéma 14: Réaction de l’énamine…………………………………………………...
15
Schéma 15: réaction amines primaires avec l’acide………………………………….
15
Schéma 16 : Triazacyclohexane symétriques…………………………………………
16
Schéma 17 : Triazacyclohexane asymétriques………………………………………..
16
Schéma 18 : Synthèse de 1, 3,5-triphényl-1, 3,5-triazacyclohexane……….…………
27
Schéma 19 : Synthèse de 1.3.bis (4-chlorophenyl)-5-benzyl-1,3,5-triazinane………...
28
Schéma 20 : Préparation d’un benzylaminium (phenylmethanaminium)…………….
29
Schéma 21 : Préparation d’un benzenaminium……………………………………….
30
Schéma 22 : Mécanisme réactionnel général de la synthèse du 1;3;5-tri (substitués)-1,
3,5-triazacyclohexanes…………………………………………………….……….
34
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
1
/
69
100%