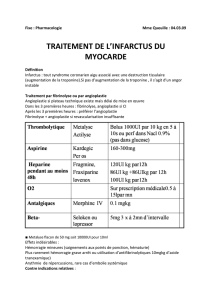
X V Journées européennes de la Société française de cardiologie

XIVes Journées européennes
de la Société française de cardiologie
Paris, 21-24 janvier 2004
LES HÉPARINES DE BAS POIDS MOLÉCULAIRE
DOIVENT-ELLES ÊTRE UTILISÉES
DANS LA FIBRILLATION AURICULAIRE ?
Ces Journées européennes ont été l’objet de nombreux débats-
controverses. Ces débats permettent à deux intervenants d’exposer
des points de vue volontairement antagonistes sur un même sujet.
Le Pr A. Cohen (Paris) défend l’utilisation des héparines de bas
poids moléculaire dans la prise en charge de l’ACFA. Il nous fait
partager son point de vue sur l’anticoagulation entourant la car-
dioversion ; en effet, pour les ACFA permanentes ou persistantes,
seule est envisageable la prise orale d’AVK au long cours. La
polémique repose en grande partie sur l’étude ACE (Anticoagu-
lation for Cardioversion using Enoxaparin), présentée en 2002 à
l’ESC, mais toujours en attente de publication.
Cette étude confirme qu’une stratégie d’anticoagulation par
énoxaparine (21 jours avant et 28 jours après la cardioversion) est
aussi efficace sur la prévention des accidents emboliques céré-
braux et périphériques que l’utilisation d’une héparine non frac-
tionnée relayée par la coumadine, et qu’elle n’entraîne pas d’aug-
mentation des événements hémorragiques (figure 1).
Pour le Pr S. Kacet (Lille), qui a exposé le point de vue antagoniste,
les grandes études AFFIRM ou RACE n’ont jamais démontré le
bénéfice d’une anticoagulation efficace dès la découverte de la
FA (avant la pleine efficacité des AVK) ; elles s’accompagnent
même d’une majoration du risque d’événements hémorragiques
durant cette période.
Par ailleurs, il nous a rappelé que l’ETO reste un examen vérita-
blement éprouvant pour les patients et que sa répétition est déli-
cate à proposer, notamment dans les stratégies courtes, même si
l’apport de cet examen est intéressant pour analyser les premières
portions de l’aorte.
L’étude HAEST (Heparin in Acute Embolic Stroke Trial),
comparant l’aspirine aux HBPM dans la récidive d’accident vas-
culaire chez les patients en fibrillation auriculaire, les premiers
jours suivant l’événement, n’avait pas mis en évidence de supé-
riorité de l’héparine.
L’étude ACE ne montre pas non plus de supériorité de l’énoxa-
parine, et reste en attente de publication officielle.
Les modalités et la durée d’anticoagulation avant, pendant et
après une cardioversion restent donc un problème non résolu. Il est
toutefois probable que ce débat héparine non fractionnée-AVK
contre HBPM dans la prise en charge de la FA soit bientôt clos avec
l’arrivée très prochaine de nouvelles molécules anticoagulantes. Les
inhibiteurs directs de la thrombine (type ximelagatran) assurent dans
cette indication une protection sur le risque embolique aussi effi-
cace que les AVK (warfarine), et diminuent le risque d’événements
hémorragiques majeurs et mineurs (études SPORTIF III et V).
L’ANGIOPLASTIE CAROTIDIENNE EST-ELLE
UN BON TRAITEMENT ?
Une autre controverse oppose le chirurgien vasculaire (Pr Kos-
kas, Paris) à l’angioplasticien (Dr Lefevre, Massy) sur la prise en
charge des sténoses carotidiennes. Dans les années 1990, deux
grands essais, NASCET et ECST, ont démontré un bénéfice de
l’endartériectomie par rapport au traitement médical seul pour
des patients ayant une sténose carotidienne sévère symptoma-
tique. Ce sont les patients présentant une sténose > 70 % (critères
américains) ou > 85 % (critères européens) pour NASCET et
> 90 % pour ECST qui en bénéficient le plus.
100
80
60
40
20
0
À 30 jours (p = 0,002) À 270 jours (p = 0,021)
Groupe 2 (amiodarone + énalapril)
Groupe 1 (amiodarone)
94
61
74
57
Figure 1. Étude ACE : critères individuels.
Première partie
La Lettre du Cardiologue - n° 374 - avril 2004
8
INFORMATIONS

Pour les sténoses entre 50 et 70 % (soit entre 75 et 85 % pour les
critères européens) selon NASCET ou entre 70 et 90 % selon
ECST, la chirurgie apporte un bénéfice moins important, qui dis-
paraît lorsque les sténoses sont < 50 % (< 75 % pour les critères
européens) selon NASCET et < 70 % pour ECST.
Les bons résultats sur les sténoses serrées se confirment à 2 ans,
avec une baisse des accidents cérébraux homolatéraux de 29 %
(traitement médical) à 9 % (endartériectomie) et, à 5 ans, de 22 %
à 15 % au profit de la chirurgie.
Fort de ces résultats, le point de vue du chirurgien ne doit pas
faire oublier que le risque de morbi-mortalité cumulée à 30 jours
est de 6,5 % pour NASCET et de 7,5 % pour ECST.
L’évolution des techniques de dilatation carotidienne (modifica-
tion des cathéters, apport des stents et protection cérébrale post-
procédure) permet de rapprocher les résultats de l’angioplastie
de ceux de la chirurgie.
Jusqu’à la fin des années 1990, la plupart des études comparant
les deux techniques comprennent peu de patients ou se heurtent
à des biais méthodologiques.
En 2001, CAVATAS (The CArotid and VertebrAl Transluminal
Angioplasty Study), première étude randomisée à grande échelle
(504 patients), montre que la chirurgie et l’angioplastie ont des
risques de mortalité et d’AVC superposables 30 jours après l’in-
tervention. Plus récemment, SAPPHIRE, présentée à l’AHA en
2002, compare dilatation + stenting carotidien avec système de
protection cérébrale chez les patients à hauts risques chirurgicaux
ayant une sténose > 80 % et asymptomatique ou > 50 % et symp-
tomatique.
L’angioplastie associée à ce système de protection se montre supé-
rieure sur la survenue du critère principal (décès, AVC ou infarc-
tus du myocarde à 30 jours) (figure 2) sans pour autant augmen-
ter les complications cérébrales, mais évite toute blessure
chirurgicale, relativement fréquente, des nerfs crâniens (figure 3).
Il paraît donc évident que, pour les patients à hauts risques chirur-
gicaux, l’angioplastie + stenting carotidien avec protection céré-
brale s’inscrit comme l’alternative logique à la chirurgie trop ris-
quée. Il manque encore, pour trancher, une étude à grande échelle,
randomisée, comparant tous les groupes de patients afin d’établir
la supériorité de l’une ou l’autre de ces méthodes. L’espoir repose
en fait sur la grande étude CREST (Carotid REvascularisation vs
Stent Trial), dont les résultats sont d’ores et déjà très attendus.
Toutefois, il faut garder à l’esprit que toutes les lésions ne se prê-
tent pas à la dilatation percutanée, même avec les meilleurs dis-
positif actuels, notamment l’existence de calcifications, la pré-
sence de plaques instables sur l’aorte, la complexité des lésions...
Indépendamment de ces critères et avant toute décision, il paraît
donc nécessaire de bien évaluer le degré de sténose carotidienne,
surtout lorsqu’elle est asymptomatique, notamment avec deux
examens d’imagerie (échographie doppler des carotides et angio-
scanner carotidien multibarrette offrant une définition proche de
celle de l’artériographie conventionnelle).
RÉSISTANCE À L’ASPIRINE CHEZ LE PATIENT
CORONARIEN
Devant l’utilisation croissante d’endoprothèses coronaires, sur
des populations de plus en plus vastes et des durées de traitement
de plus en plus longues, la question de la résistance aux anti-
agrégants se pose logiquement.
L’utilisation d’aspirine à une dose quotidienne ≥0,5 mg/kg inhibe,
à plus de 95 % entre deux prises, la capacité plaquettaire de syn-
thèse de thromboxane. Toutefois, la variabilité interindividuelle de
réponse au traitement antiagrégant est importante. Reste à savoir
si, pour certains patients, il peut exister une résistance aux anti-
agrégants, et quelle serait sa traduction clinique. En effet, il ne suffit
pas de dire qu’il y a résistance à l’aspirine lorsque survient une
récidive d’accident ischémique. L’analyse biologique de réactivité
plaquettaire est difficile, car elle se heurte à de nombreux problèmes
(voies d’antiagrégation multiples et ayant chacune des tests d’ana-
lyse différents, manque de fiabilité de certains tests, etc.).
Il faut retenir que, dans de nombreux cas, les principales causes
de “résistance” à l’aspirine sont :
1. L’observance insuffisante du traitement antiagrégant : pas plus
de 80 % dans certaines études.
2. L’effet dose-efficacité : même s’il ne semble pas que la dose
soit une explication majeure de la résistance à l’aspirine, une dose
répétée de 100 mg/j suffit à bloquer efficacement au long cours
l’antiagrégation plaquettaire.
3. L’interaction avec certains médicaments :
– notamment les AINS, comme l’ibuprofène, qui inhibe de
manière compétitive l’effet antiagrégant plaquettaire de l’aspi-
rine, lorsqu’il est donné en association ;
– la cholestyramine et les sels d’aluminium, qui diminuent l’ab-
sorption digestive ;
5,8 6,7
11,2
4,2
12,6
15,4
Tous, p = 0,047
Symptomatiques, p = NS
Asymptomatiques, p = NS
20
15
10
5
0
Stenting
carotidien (%) Endartériectomie
carotidienne (%)
Figure 2. Étude SAPPHIRE : critère principal (décès, AVC ou infarctus
du myocarde à 30 jours), pour tous les patients, et pour les patients
asymptomatiques et symptomatiques.
AIT, p = NS Hémorragie majeure, p = NS
Lésion nerfs crâniens, p < 0,01
3,8
8,3
02
10,6
5,3
12
10
8
6
4
2
0Stenting
carotidien (%)
Endartériectomie
carotidienne (%)
Figure 3. Étude SAPPHIRE : complications à 30 jours.
La Lettre du Cardiologue - n° 374 - avril 2004
9
I
NFORMATIONS

– la corticothérapie, qui diminue les concentration des salicylates
en augmentant leur élimination.
– le clopidogrel, dont la résistance a été décrite surtout les pre-
miers jours de traitement ; les causes pharmacologiques comme
les interactions spécifiques avec le cytochrome P450 sont en cours
d’étude.
Si la traduction clinique de ces phénomènes de résistance reste
difficile à préciser, il est maintenant acquis que l’arrêt intempes-
tif de l’aspirine (souvent décidé par le médecin lui-même) est très
délétère.
L’équipe de G. Montalescot et J.P. Collet a démontré récemment
que l’arrêt brutal de l’aspirine chez les patients traités au long
cours était néfaste. En effet, ces patients, hospitalisés pour syn-
drome coronaire aigu (en moyenne 11,9 j ± 0,8 j après l’arrêt de
l’aspirine), avaient un risque accru d’infarctus du myocarde
(IDM) ou de décès à 30 jours par rapport aux patients prenant
régulièrement leur traitement (figure 4).
Les arrêts étaient, le plus souvent, demandés par le médecin,
notamment en prévision d’une chirurgie (65 %), décidés par le
patient (25 %) ou, plus rarement, motivés par une complication
hémorragique (8 %).
Conclusion. La résistance à l’aspirine est un phénomène rare,
dont la mise en évidence biologique est complexe. Avant de par-
ler de résistance, il faut éliminer une mauvaise observance, fré-
quente, de la prise d’aspirine (prises aléatoires et/ou trop espa-
cées, arrêt complet).
Il faut se méfier de l’interaction de certains médicaments inhi-
bant l’effet antiagrégant (en particulier l’ibuprofène).
Enfin, l’arrêt brutal de l’aspirine chez les patients coronariens
traités au long cours est néfaste, car il est associé à une surmor-
talité en cas de récidive de syndrome coronarien.
PRESCRIPTION D’AINS ET CARDIOLOGIE
Une mise au point intéressante, rapportée par J. Amar (Toulouse),
concerne les interactions de la prescription des anti-inflamma-
toires non stéroïdiens (AINS) traditionnels ou de coxibs sur la
fonction cardiaque et rénale.
Le mode d’action des AINS passe par l’inhibition de la cyclo-
oxygénase (COX), enzyme intervenant dans la synthèse de pros-
taglandines (protégeant la muqueuse gastrique, entre autres) et
de la thromboxane A2 (vasoconstrictive et proagrégante).
Les AINS traditionnels sont des inhibiteurs de la COX-1, ubi-
quitaire et non inductible, et de la COX-2, inductible et présente
surtout dans le rein et les vaisseaux. Les coxibs inhibent préfé-
rentiellement la COX-2, limitant les effets gastriques.
Effets sur la pression artérielle
L’action sur le rein, par l’inhibition des prostaglandines, provoque
une rétention de sel, une augmentation des résistances vasculaires
périphériques et une élévation de la pression artérielle ; elle pro-
voque également une augmentation de la kaliémie et une dimi-
nution de la filtration glomérulaire pouvant conduire à l’insuffi-
sance rénale.
L’effet hypertenseur des AINS (surtout avec l’indométacine,
le naproxène et le piroxicam) apparaissant chez le normotendu
est d’autant plus marqué qu’il existe une hypertension arté-
rielle, particulièrement si le patient reçoit un traitement par
bêtabloquant, ARA II ou IEC (blocage du système rénine)
(figure 5).
L’augmentation de la pression artérielle due aux coxibs est proche
de celle sous AINS traditionnels. Il semble toutefois, selon l’étude
VIGOR, que les effets sur la pression artérielle soient moins mar-
qués avec le célécoxib (Celebrex®) qu’avec le rofécoxib (Vioxx®).
Autres effets sur le rein
Les risques d’hyperkaliémie et d’insuffisance rénale sous coxibs
et AINS traditionnels sont équivalents. Ces risques sont majorés
chez les sujets âgés, les insuffisants rénaux, les patients diabé-
tiques, et lorsqu’il y a déjà une prise d’IEC, d’ARA II, d’anti-
aldostérone ou de diurétiques.
Risque d’insuffisance cardiaque
Les AINS majorent le risque d’insuffisance cardiaque. G. Rodri-
guez et S. Hernandez-Diaz ont évalué l’association de la prise
chronique d’AINS et de risque de premier épisode d’insuffisance
cardiaque dans une cohorte d’individus allant de 40 à 84 ans.
La prise d’AINS entraîne un risque relatif (RR) d’insuffisance
8,9 9,9
19,2 21,9
10,3 12,4
Pas d'aspirine avant l'hospitalisation
Aspirine antérieurement Arrêt aspirine récent
Décès Décès ou IDM
25
20
15
10
5
0
Pourcentage de patients
Figure 4. Décès et/ou IDM lors de l’arrêt de l’aspirine, par rapport aux
patients sous aspirine au long cours, et sans aspirine avant l’hospitalisa-
tion. La différence est significative entre le groupe “arrêt aspirine” (en
jaune) et les deux autres groupes. D’après J.P. Collet, 2003.
1
3
5
6
0
2
1
4
3
6
5
Augmentation de la pression artérielle moyenne
(mmHg)
Normotendus Hypertendus Hypertendus traités
Hypertendus traités par bêtabloquants ou ARA II ou IEC
Figure 5. Augmentation de la pression artérielle moyenne sous AINS
(méta-analyse, d’après Johnson et al., 1994).
La Lettre du Cardiologue - n° 374 - avril 2004
10
I
NFORMATIONS

cardiaque de 1,9 dans la population générale ; ce risque passe à
2,3 en cas d’HTA, et à 2,9 lorsque l’HTA est traitée par IEC ; un
anté
cédent d’insuffisance cardiaque augmente ce risque à 9,9
(figure 6).
Le risque de développer un épisode d’insuffisance cardiaque est
maximal pendant le premier mois de traitement par AINS.
Effets sur l’agrégation plaquettaire
Toujours dans l’étude VIGOR, les coxibs, par l’interaction throm-
boxane/prostaglandine, pourraient favoriser un état prothrombo-
tique, délétère chez les patients à haut risque cardiovasculaire.
Rappelons qu’à l’heure actuelle aucune étude ne permet d’affir-
mer que les AINS peuvent remplacer l’aspirine dans la préven-
tion (primaire ou secondaire) des accidents artériels, en particu-
lier coronariens.
Conclusion
Les AINS traditionnels et les coxibs augmentent la pression
artérielle chez les sujets sains, de manière plus importante chez
les hypertendus, en particulier lorsqu’il y a un bloqueur de la
rénine.
L’ajout d’AINS ou de coxibs chez les sujets âgés, souffrant d’une
insuffisance cardiaque et souvent polymédiqués (IEC et/ou
ARA II, antialdostérone, bêtabloquants), expose considérable-
ment au risque d’insuffisance rénale.
Le risque de premier épisode d’insuffisance cardiaque chez les
patients traités au long cours par AINS est multiplié par deux, et
par trois lorsqu’il existe une HTA traitée par IEC.
L’épisode d’insuffisance cardiaque survient le plus souvent au
cours du premier mois de traitement par AINS.
Les AINS ne peuvent pas se substituer à l’aspirine dans la
prévention (primaire ou secondaire) des accidents artériels, en
particulier coronariens.
Il semble que les coxibs favorisent un état prothrombotique délé-
tère chez le patient vasculaire.
F. Raoux, Institut de cardiologie, CHU Pitié-Salpêtrière, Paris
FLASHES D’ACTUALITÉS EN RYTHMOLOGIE
Le bloc auriculoventriculaire congénital
Le BAV congénital (BAV C) est défini communément comme un
BAV existant depuis la naissance. Les étiologies principales en
sont les malformations cardiaques complexes et l’association
fréquente avec la présence d’anticorps circulants chez la mère,
porteuse ou non d’une maladie dysimmunitaire de type lupus ou
syndrome de Gougerot-Sjögren. Plus rarement, le BAV se révèle
dans l’enfance, et son origine est alors familiale, dégénérative,
ou bien liée à une myocardiopathie.
Sa fréquence est de 1/10 000 naissances d’enfants vivants et serait
secondaire au passage d’anticorps maternels au fœtus. Les anti-
corps anti-SSa et anti-SSb sont retrouvés chez environ 98 % des
mères de ces enfants.
Toutefois, une mère qui possède ces anticorps ne court un risque
d’avoir un enfant avec un BAV que de 2 à 3 % ; ce risque passe
à 15 % si elle a eu un enfant avec un BAV à sa première gros-
sesse ! Ces anticorps sont principalement dirigés contre le canal
calcique et induisent également une apoptose et la constitution
d’une fibrose. Le phénotype en est très variable, allant du PR long
au BAV complet.
L’implantation d’un pacemaker reste le traitement du BAV C. Elle
est justifiée même si l’enfant semble bien portant, car il existe un
risque de syncope et de mort subite quand la fréquence cardiaque
moyenne dans la journée est inférieure à 50 battements/mn.
Le respect strict des Guidelines de l’ACC/AHA/NASPE 2002
permet d’éviter la plupart du temps la mort subite de ces enfants.
Rappelons qu’il faut appareiller les enfants ayant un BAV II ou
III :
✓associé à une bradycardie symptomatique : insuffisance car-
diaque, syncope, mauvaise tolérance à l’exercice ;
✓associé à une dysfonction ventriculaire (clinique, échogra-
phique) ;
✓avec un échappement ventriculaire à QRS larges, des torsades
de pointes, des troubles du rythme ventriculaire ;
✓avec un échappement ventriculaire lent défini selon l’âge :
< 50-55 bpm chez l’enfant < 2 ans, entre 45 et 50 bpm entre 2 et
4 ans, < 40-45 bpm au-delà de 4 ans ;
✓avec une pause égale à deux à trois fois la durée du cycle de
base.
Les modalités d’appareillage sont la voie épicardique chez le nou-
veau-né et l’enfant de moins de 10 kg. Le Dr Villain (hôpital
Necker, Paris) rapporte, dans une série de 31 patients vus à
l’hôpital Necker, une mortalité peropératoire nulle, mais 25 % de
reprise chirurgicale pour déplacement ou rupture d’électrodes.
À partir de 10 kg, la stimulation est endocavitaire simple chambre
avec fréquence asservie initialement, puis double chambre. Les
complications sont les difficultés d’accès veineux, et des seuils
instables chez l’enfant.
La complication principale tardive, quel que soit le type de BAV
et malgré l’appareillage, reste l’apparition de myocardiopathies,
pour lesquelles il n’y a pas de solution actuellement en dehors
d’une surveillance accrue des enfants en échographie et du recours
à la stimulation biventriculaire, encore en évaluation chez ces
enfants.
1,9 2,3 2,9
9,9
Population générale Hypertendus Hypertendus sous IEC
Antécédent d'insuffisance cardiaque
0
2
4
6
8
Risque relatif
10
Figure 6. Risque relatif de développer un épisode d’insuffisance car-
diaque sous AINS.
La Lettre du Cardiologue - n° 374 - avril 2004
11
I
NFORMATIONS
.../...

En conclusion, il existe deux formes physiopathologiques de
BAV congénital.
1. La forme secondaire aux anticorps maternels : elle touche le
fœtus et le nouveau-né et nécessite la mise en place très précoce
d’un stimulateur. Ces enfants ont une mauvaise survie actuarielle
et développent des myocardiopathies.
2. La forme plus favorable : elle concerne l’enfant de plus de deux
ans chez qui il n’est pas retrouvé d’anticorps et dont la physio-
pathologie n’est pas connue.
L’implantation d’un stimulateur dans le respect strict des guide-
lines permet d’éviter la mort subite chez ces enfants.
L’apparition de myocardiopathies tardives reste le principal pro-
blème à résoudre et justifie un suivi rapproché, clinique et écho-
graphique, de ces enfants.
Les infections sur sondes de pacemaker
Les données dont nous disposons pour poser le diagnostic d’in-
fection sur sondes de pacemaker se rapportent essentiellement à
des études rétrospectives. Celles-ci nous montrent que plus de
85 % de ces patients ont de la fièvre, que 95 % ont un bilan inflam-
matoire perturbé, et 91 % des végétations en échographie trans-
œsophagienne (ETO).
Au cours d’une étude prospective, le Dr Klug, avec l’équipe du
Pr Kacet (Lille), retrouve des données très différentes (figure 7),
avec seulement un tiers des patients ayant de la fièvre, la moitié
des signes locaux et un bilan inflammatoire perturbé, et 44 % des
végétations en ETO.
Ces examens ont donc une bonne valeur prédictive positive, mais
ne permettent pas d’éliminer le diagnostic s’ils sont normaux.
De la même façon, la notion de complication locale reste trop
souvent considérée comme une simple complication mécanique
isolée du fait d’examens complémentaires négatifs.
Ainsi, sur 105 patients se présentant avec une complication locale
sans fièvre, sans végétations en ETO et sans histoire d’endocar-
dite, le Dr Klug a retiré systématiquement les sondes et les a mises
en culture : elles s’avèrent presque toujours positives, et dans leur
totalité (figure 8).
La culture locale au site du boîtier est, quant à elle, rarement posi-
tive, et elle constitue un mauvais examen pour exclure le dia-
gnostic.
Dans une série de 224 patients, quelle que soit la présentation cli-
nique (allant de l’infection systémique à la complication locale),
12 % ont une culture de sonde négative, 88 % une infection de la
totalité de la sonde au même germe, et 25 % ont une infection
polymicrobienne (figure 9).
Ces résultats incitent à mettre en culture la totalité de la sonde
afin d’adapter au mieux l’antibiothérapie aux différents germes
qui peuvent être retrouvés de la portion extravasculaire à la por-
tion intravasculaire.
L’échec ou le retrait incomplet de la sonde se compliquent, dans
cette série, d’un taux de récidive de 50 %, avec une mortalité de
12,5 %. Il ne faut pas oublier non plus que la procédure d’extrac-
tion n’est pas dénuée de risque, avec une mortalité opératoire de
2%.
En ce qui concerne les hémocultures, lorsqu’il y a au moins deux
hémocultures positives, la sonde est infectée dans 91% des cas.
D’autre part, une seule hémoculture positive à Staphylococcus
56 %
41 %
34 % 39 %
44 %
Hémoc. CRP Hyperleuco-
cytose Scinti. pulm. ETO
60
50
40
30
20
10
Étude prospective sur 394 patients
Figure 7. Proportion d’examens complémentaires contributifs chez des
patients suspects d’infection sur sonde de PM.
1. 12,3 % de cultures négatives
2. Bactéries retrouvées tout le long de la sonde
chez 88,4 % des patients
3. 25 % d'infections polymicrobiennes
4. Résultat indépendant de la présentation clinique.
Staphylococcus
epidermidis
68 %
Staphylococcus
aureus
8 %
Streptococcus
3,6 %
SCN
21 %
BGN
5,8 %
Figure 9. Fréquence des germes retrouvés.
Prélèvement local
Prélèvement portion
extravasculaire
Prélèvement portion
intravasculaire
100
80
60
40
20
37,5
100
83,5
35,5
92,8
76,9
50
96,1
77,7
87,2
36
78,3
Inflammation Menace
d’extériorisation
Extériorisation Infection
Figure 8. Résultats bactériologiques des cultures des différentes portions
de sonde en fonction du tableau clinique.
La Lettre du Cardiologue - n° 374 - avril 2004
13
I
NFORMATIONS
.../...
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%