L’ Les antiangiogéniques ACTUALITÉS ASCO 2008

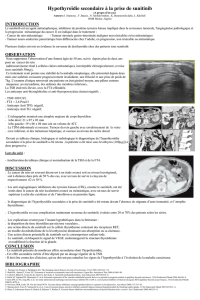
Figure. Principaux mécanismes d’action des antiangiogéniques.
VEGF TRAP
Ac anti-VEGF
(bévacizumab)
Ac anti-VEGFR2
Inhibiteur de
tyrosine kinase
VEGFR-1
soluble
VEGF-B
VEGFR-1 VEGFR-2 VEGFR-3
EGF, PDGF, bFGF, IGF-1, VHL,
IL-6, IL-8, H2O2, COX-2
Hypoxie, NO, oncogènes
Leurre : détourne le VEGF-A
du VEGFR-2
Induction de MMP9
et facteurs de croissance
Lymphoangiogenèse
Prolifération
Migration
Survie
Angiogenèse
Prolifération
Migration
Survie
Perméabilité
Cellule
endothéliale
sanguine
Cellule
endothéliale
lymphatique
VEGF-C
VEGF-D
VEGF-A
Récepteurs du VEGF
La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008 | 3
ACTUALITÉS
ASCO 2008
Les antiangiogéniques
V. Boige*, G. El Maalouf**
L’
existence d’une hypervascularisation au sein
des tumeurs est connue depuis plus d’un
siècle, et celle de facteurs stimulant la crois-
sance vasculaire et permettant la mise en place d’une
néovascularisation au sein d’une tumeur l’est depuis
plus de soixante ans. Le premier à soulever l’hypo-
thèse que l’angiogenèse pourrait être un processus
indispensable au développement des tumeurs a été
Judah Folkman, en 1971. La deuxième étape impor-
tante a été la découverte puis le clonage du vascular
endothelial growth factor (VEGF), facteur clé de
l’angio genèse, au début des années 1990. Depuis, la
recherche sur l’angiogenèse et les antiangiogéniques
s’est accélérée et a permis la mise au point récente
de molécules appartenant à une nouvelle classe de
traitements, celle des antiangiogéniques. Actuelle-
ment, plus de 60 molécules antiangiogéniques sont
en cours d’expérimentation, dans la grande majorité
des cas dans le cadre de thérapies antitumorales.
Certaines molécules ciblant le VEGF ou ses récep-
teurs sont déjà utilisées en pratique clinique dans
le cadre d’une AMM (bévacizumab, sunitinib, sora-
fénib), d’autres sont en cours de développement dans
le cadre d’essais cliniques. Depuis plusieurs années,
les thérapies moléculaires ciblées, notamment les
antiangiogéniques, font l’objet d’une recherche
clinique et translationnelle très riche. Cette revue
a pour but de synthétiser les principaux résultats
cliniques présentés à l’ASCO 2008 sur les différents
antiangiogéniques, et, plus particulièrement, le suni-
tinib et l’axitinib.
Rappel sur les principaux
antiangiogéniques
et leurs mécanismes d’action
Plusieurs mécanismes d’action des médicaments
antiangiogéniques permettent d’aboutir à une
diminution de l’angiogenèse tumorale, associée ou
non à un effet antiprolifératif direct sur les cellules
tumorales dans le cas des inhibiteurs multicibles.
Les principaux inhibiteurs de l’angiogenèse ciblent
le VEGF ou son récepteur (VEGFR) [figure].
Le bévacizumab (Avastin®)
➤
est un anticorps
anti-VEGF obtenu par l’humanisation de l’anticorps
(Ac) Mab A.4.6.1 qui avait montré des propriétés
d’inhi bition sur des lignées cellulaires tumorales
humaines introduites chez des souris nude. Cet Ac
fixe et neutralise toutes les isoformes du VEGF-A
et ses fragments protéolytiques actifs, mais ne
reconnaît pas les VEGF-B et C. Sa demi-vie est de
17 à 21 jours. Le bévacizumab inhibe la croissance
de cellules tumorales chez la souris in vivo, avec un
effet maximal à la dose de 1-2 mg/ kg x 2/ sem. Les
indications faisant l’objet d’une AMM sont le cancer
colorectal, le cancer du poumon non à petites cellules
(CPNPC), le cancer du sein métastatique en première
ligne en association avec la chimiothérapie, et le
cancer du rein en association avec l’interféron.
* Département de médecine, institut
Gustave-Roussy, Villejuif.
** Service interhospitalier de cancé-
rologie Bichat-Beaujon, Clichy.

4 | La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008
Les antiangiogéniques
ACTUALITÉS
ASCO 2008
Le sunitinib malate (Sutent®) ➤ ou SU11248 est
un inhibiteur multicible inhibant à la fois VEGFR-1,
VEGFR-2, VEGFR-3, FLT3, Kit, PDGFR-β et PDGFR-α.
Il s’administre per os. In vivo, le sunitinib provoque
une diminution de la densité microvasculaire, une
prévention de la néo-vascularisation et une dimi-
nution de la formation de métastases pulmonaires
dans un modèle de cancer du poumon chez la souris.
Il a obtenu en 2006 l’AMM dans le cancer du rein
avancé et/ou métastatique et dans les gastrointes-
tinal stromal tumors (GIST) résistantes ou intolé-
rantes à l’imatinib.
Le sorafénib (Nexavar®)
➤
ou BAY 43-9006 inhibe
également plusieurs kinases pro-angiogéniques,
mais aussi la voie de signalisation Raf/ Ras/ Erk. Il a
en effet été démontré un effet inhibiteur de Raf-1
associé à un effet antiprolifératif sur des lignées
de cellules tumorales in vitro et in vivo dans des
modèles de xénogreffes de tumeurs humaines. Il a
également été montré que cette molécule pouvait
inhiber VEGFR-2, PDGFR-β ou VEGFR-3. Cet inhi-
biteur de tyrosines kinases multicible, comme le
sunitinib, s’administre per os. L’AMM du sorafénib
a été accordée dans le cancer du rein métastatique
en deuxième ligne et, plus récemment, dans le carci-
nome hépatocellulaire (CHC) en première ligne de
traitement systémique.
L’axitinib
➤
ou AG-013736 inhibe tous les
sous-types de VEGFR, PDGFR-β et c-kit. In vitro,
l’AG-013736 bloque de façon sélective l’autophos-
phorylation des récepteurs activés par le VEGF, ce
qui aboutit à une inhibition de la prolifération des
cellules endothéliales et de la survie de ces cellules.
Cela est associé à une diminution de la densité tumo-
rale en microvaisseaux et à une augmentation de la
nécrose tumorale dans des modèles de xénogreffes
de tumeurs humaines chez la souris. L’axitinib est
actuellement en essai clinique dans plusieurs types
de tumeurs solides, comme le cancer du rein, du
pancréas et le mélanome.
Principaux résultats
des antiangiogéniques
à l’ASCO 2008
Les résultats de plusieurs grands essais de phase III
très attendus testant l’efficacité des principaux
antiangiogéniques déjà disponibles dans plusieurs
pathologies, en association ou non à une chimio-
thérapie cytotoxique, ont été rapportés.
En ce qui concerne le bévacizumab, les résultats
de l’essai AVADO testant l’association docétaxel/
bévacizumab versus docétaxel/ placebo en première
ligne métastatique dans le cancer du sein montrent
un bénéfice statistiquement significatif de ce trai-
tement par rapport au docétaxel seul, à la fois en
termes de taux de réponse objective (RO), et de
survie sans progression (SSP). Les résultats en termes
de survie globale (SG) ne sont toutefois pas encore
disponibles (1).
La mise à jour de l’essai AVOREN comparant un
traitement combiné par interféron/bévacizumab
versus interféron seul en première ligne métasta-
tique dans le cancer du rein confirme le bénéfice
apporté par le bévacizumab en termes de SSP, quel
que soit le sous-type histologique de la tumeur,
et ce indépendamment du taux sérique de base
du VEGF, de la fonction rénale, de l’apparition ou
non d’une HTA ou d’une protéinurie (2). Notons
que l’asso ciation du bévacizumab au sorafénib,
moyennant une réduction de posologie de ce
dernier compte tenu d’une surtoxicité, notamment
cutanée, a des résultats encourageants en termes
de taux de réponse et de SSP dans cette même
pathologie (3).
Les résultats d’une deuxième étude de phase III,
CAIRO 2, confirment l’effet délétère de la combi-
naison de deux classes d’anticorps, le bévacizumab
et le cétuximab et, plus généralement, des anticorps
dirigés contre le récepteur à l’EGF, en association à
une chimiothérapie dans le traitement de première
ligne du cancer colorectal métastatique, comme
l’avait précédemment montré l’essai PACCE avec
le panitumumab (4). Cet effet délétère sur la SSP
n’est pas le résultat d’un arrêt prématuré du trai-
tement pour surtoxicité, et demeure actuellement
non élucidé.
La grande déception vient une fois de plus du cancer
du pancréas, avec les résultats négatifs de l’étude
de phase III AVITA comparant une trithérapie par
bévacizumab/gemcitabine/erlotinib à une bithé-
rapie par gemcitabine/erlotinib/placebo en première
ligne métastatique (5). En effet, en dépit d’une
meilleure SSP en faveur du traitement par béva-
cizumab (4,6 mois versus 3,6 mois), la SG n’était
pas significativement différente entre les deux bras
(7,1 mois versus 6 mois).
Enfin, l’effet bénéfique du sorafénib sur la SSP et la
SG chez les patients atteints d’un CHC inopérable
est confirmé par une seconde étude de phase III
asiatique comparant sorafénib et placebo et ayant
inclus 226 patients avec CHC et cirrhose compensée
(score Child-Pugh A) : les résultats sont très proches
de ceux rapportés dans la première étude présentée
à l’ASCO 2007 en séance plénière (6).

La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008 | 5
ACTUALITÉS
ASCO 2008
Principaux résultats cliniques
du sunitinib et de l’axitinib
Sunitinib
Données de survie globale ◆
dans le cancer du rein
Une mise à jour des données relatives à la survie dans
l’essai de phase III comparant le sunitinib à l’inter-
féron-α (IFNα) en première ligne de traitement du
cancer du rein métastatique a été communiquée (7).
L’analyse des 750 patients inclus a confirmé la supé-
riorité du sunitinib en termes de taux de RO (47 %
versus 12 % ; p < 0,000001) et de SSP (11 mois versus
5 mois ; p < 0,000001). Les principales toxicités
sévères du sunitinib étaient l’HTA (12 %), la fatigue
(11 %), la diarrhée (8 %) et le syndrome mains-pieds
(8 %). La médiane de SG était supérieure à 2 ans dans
le bras sunitinib (26,4 mois), versus 21,8 mois dans
le bras IFN (p = 0,051), et 20 mois si l’on exclut du
bras IFN les patients ayant bénéficié d’un cross over
(p = 0,0362). Dans le sous-groupe des patients
n’ayant reçu que le traitement protocolaire, la survie
médiane était de 28,1 mois dans le bras sunitinib,
versus 14,1 mois dans le bras IFN (p = 0,0033).
Tolérance du sunitinib chez les patients ◆
ayant des métastases cérébrales
Une étude internationale a été menée spécifique-
ment chez des malades inéligibles pour un essai
thérapeutique en raison de l’existence de métastases
cérébrales asymptomatiques et qui ont été traités
par sunitinib à dose normale (50 mg/ j 4 semaines
sur 6) [8]. Il s’agissait de 298 patients, dont 77 %
étaient prétraités par cytokines. Avec une durée
médiane de traitement de 4,3 mois, le profil de tolé-
rance n’était pas différent de celui constaté chez les
patients sans métastases cérébrales. Un seul patient
a présenté un épisode d’hémorragie cérébrale de
grade 1/ 2. Une réponse partielle (RP) et une stabili-
sation des métastases cérébrales supérieure à 3 mois
ont été observées chez 11 % et 51 % des patients,
respectivement. La médiane de SSP était de 5,6 mois
et 5,3 mois chez les patients ayant ou n’ayant pas
reçu de traitement antérieur par cytokine, respec-
tivement. Cette étude, bien que non randomisée,
apporte donc des arguments plutôt en faveur d’une
certaine efficacité du sunitinib dans cette population
de mauvais pronostic, sans surtoxicité évidente.
Données relatives à la tolérance ◆
à long terme du sunitinib
Les données de tolérance d’un traitement par suni-
tinib à long terme (> 6 mois) ont été rapportées
chez 2 084 des 4 616 patients traités en première
et deuxième lignes thérapeutiques pour un cancer
rénal métastatique (9). Un événement indésirable
sévère lié au traitement a été observé chez 39 %
des patients traités à long terme versus 12 % des
1 913 patients traités moins de 6 mois, mais seuls
8 % ont dû interrompre le traitement pour toxicité,
versus 13 % dans le groupe traité à court terme, ce
qui suggère l’absence de toxicité cumulative sévère,
en particulier cardiovasculaire, présente chez moins
de 1 % des patients dans les 2 groupes.
Données d’efficacité chez les patients ◆
ayant une GIST prétraitée par imatinib
Les résultats d’efficacité et de tolérance du sunitinib
administré à la dose de 50 mg/ j 4 semaines sur 6 à
une cohorte de 1 091 patients atteints d’une GIST
après échec d’un premier traitement par imatinib
ont été rapportés (10). La médiane de temps jusqu’à
progression (TTP) était de 37 semaines, et la médiane
de SG de 73 semaines. Cette dernière différait en
fonction des doses d’imatinib précédemment admi-
nistrées en première ligne (93 semaines en cas de
dose < 400 mg/ j versus 34 semaines en cas de dose
> 800 mg/ j) et de la cause de l’arrêt du traitement
par imatinib (122 semaines en cas d’arrêt pour into-
lérance, 60 semaines en cas de progression tumorale
après moins de 6 mois d’imatinib, versus 73 semaines
en cas de progression tumorale après plus de 6 mois
d’imatinib). Les principales toxicités de grade 3/ 4
étaient une asthénie (10 %), des douleurs abdo-
minales (10 %), un syndrome mains-pieds (9 %),
une anémie (8 %), une neutropénie (8 %), et une
thrombopénie (5 %). Une hypothyroïdie, tous grades
confondus, a été rapportée chez 7 % des patients,
et une HTA chez 23 % d’entre eux (dont 6 % de
grade 3/ 4). Une insuffisance cardiaque a été observée
dans moins de 0,5 % des cas. Au total, ces données
sont comparables à celles obtenues chez les patients
inclus dans les essais thérapeutiques.
Données d’efficacité en cas de sarcomes ◆
des tissus mous non GIST
Une étude de phase II a évalué l’efficacité du suni-
tinib en administration continue de 37,5 mg/ j chez
des patients atteints de sarcomes des tissus mous
non GIST répartis en 2 groupes histologiques en
fonction du caractère sensible connu (groupe A,
n = 20) ou non (groupe B, n = 21) aux inhibiteurs de
thyrosine kinases (11). Sur un total de 39 patients
évaluables, 3 patients du groupe A et 4 patients
du groupe B ont eu une maladie stabilisée plus de
16 semaines, et un patient du groupe B porteur

6 | La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008
Les antiangiogéniques
ACTUALITÉS
ASCO 2008
d’une tumeur desmoplastique à petites cellules
rondes a présenté une RP confirmée et durable.
D’autres études devront bien sûr confirmer ces
données encourageantes.
Pharmacocinétique et marqueurs prédictifs ◆
clinico-biologiques
Une grande étude pharmacocinétique portant sur le
sunitinib, réalisée à partir de 12 études occidentales
et de 2 études japonaises, et incluant des volon-
taires sains, des patients atteints de GIST, de cancer
du rein, d’autres tumeurs solides ou de leucémies
myéloïdes chroniques (LMC), montre une demi-vie
de la molécule et de son métabolite, le SU012662,
de 69 et 80 heures, respectivement (12). Contrai-
rement à l’état général, au poids, et à la clairance
rénale, la présence d’une tumeur solide était le prin-
cipal facteur de variation de la clairance, celle-ci
pouvant être diminuée de 26 % à 29 %, quel que
soit le type de tumeur. La clairance est diminuée de
12 % et 13 % chez les Asiatiques, et de 9 % et 26 %
chez les femmes occidentales et asiatiques pour le
sunitinib et son métabolite, respectivement, ce dont
résultent de faibles changements en termes d’ASC
et de Cmax. Aucun de ces facteurs ne doit donc faire
adapter la posologie.
Des anomalies biologiques de la fonction thyroï-
dienne sont fréquemment observées sous sunitinib,
sans que les mécanismes physiopathologiques en
soient élucidés. Après l’évaluation prospective de la
biologie thyroïdienne de 40 patients traités à la dose
de 50 mg/ j pour un cancer du rein métastatique, des
anomalies ont été constatées chez 28 d’entre eux
(70 %), dont 13 (32,5 %) présentaient une hypothy-
roïdie symptomatique nécessitant un traitement
substitutif (13). Les médianes de SSP et de SG des
12 patients sans anomalies du bilan thyroïdien
étaient de 3,6 mois et 6,6 mois, versus 10,3 mois
et 18,2 mois chez les 28 autres (p = 0,047 et p = 0,13,
respectivement). L’apparition d’une hypothyroïdie
biologique pourrait donc être un facteur prédictif
de l’efficacité du traitement, mais cela mérite d’être
confirmé de manière prospective chez un plus grand
nombre de patients.
Des biomarqueurs prédictifs de l’efficacité du suni-
tinib ont été identifiés chez des patients atteints de
CHC traités dans le cadre d’un essai de phase II (14).
À l’issue du premier cycle, une augmentation du
taux de VEGF-A (3 fois le taux de base en moyenne)
et une diminution du taux de VEGFR-2, -3 et de KIT
solubles de 50 %, 70 % et 30 % respectivement
étaient observés. Un taux préthérapeutique élevé
de VEGF-C (> 822 pg/ ml) était corrélé à un TTP et
à une SG plus longs (TTP, p = 0,004 ; SG, p = 0,05).
La baisse de KIT soluble à J14 était aussi prédic-
tive d’un TTP plus long (p = 0,018), d’une réponse
évaluée selon les critères de Choi (p = 0,012), et
d’un volume de nécrose plus important (p = 0,02).
La baisse du VEGFR-3 soluble était également
prédictive de la réponse (p = 0,005). L’augmenta-
tion du VEGF-A (p = 0,03) et la baisse du VEGFR-2
soluble (p = 0,036) étaient aussi prédictives de la
nécrose tumorale. Si elles se voient confirmées sur
d’autres populations et d’autres types tumoraux,
ces données biologiques pronostiques et prédictives
permettront probablement d’identifier, à terme,
les patients qui bénéficient le plus d’un traitement
par sunitinib.
Axitinib
L’axitinib est actuellement développé dans le cancer
du rein, du pancréas, de la thyroïde, le cancer bron-
chique et le mélanome.
Données d’efficacité en cas de cancer du rein ◆
après échec d’une première ligne de traitement
antiangiogénique
Une étude de phase II a testé cette molécule à la
dose de 5 mg x 2/ j, augmentée jusqu’à 10 mg x 2/ j
en fonction de la tolérance, sur des patients atteints
de cancer du rein métastatique après échec d’un
traitement par sorafénib et sunitinib (n = 14), par
sorafénib et cytokines (n = 29), ou par sorafénib seul
(n = 15) [15]. Pour chacun des groupes, le taux de
RO était de 7 %, 28 % et 27 %, et la SSP de 7,1 mois,
9 mois et 7,7 mois, respectivement. Les principaux
effets indésirables sévères étaient l’asthénie (13 %),
l’HTA (11 %), le syndrome mains-pieds (11 %), la
diarrhée (5 %) et la dyspnée (5 %). La posologie a
pu être augmentée de 5 à 10 mg x 2/ j pour 57 % des
patients et a dû être diminuée pour 15,5 % d’entre
eux. Ces résultats sont en faveur de l’absence de
résistance croisée entre l’axitinib, d’une part, et le
sorafénib ou le sunitinib, d’autre part. Une étude de
phase III est prévue pour les patients réfractaires
aux traitements de première ligne dans le cancer
du rein métastatique.
Données d’efficacité dans le mélanome ◆
métastatique
Une étude de phase II a également été menée
dans le mélanome métastatique sur 32 patients
non prétraités ou n’ayant reçu qu’une seule ligne
de traitement à la dose de 5 mg x 2/ j (16). Le même

La Lettre du Cancérologue • Supplément 5 au n° 7 - Vol. XVII - septembre 2008 | 7
ACTUALITÉS
ASCO 2008
profil de tolérance que celui de l’étude précitée a
été observé, avec comme principales toxicités une
asthénie (62,5 %), une HTA (43,8 %), une dysphonie
(34,4 %) et une diarrhée (31,3 %). Un cas de décès
toxique à la suite d’une perforation digestive a
été rapporté. Le taux de réponse évaluée par les
critères RECIST était de 15,6 %, avec une durée de
réponse allant de 2,3 mois à 10,2 mois. La médiane
de SSP était de 2,3 mois, et la SG de 6,8 mois. Un
facteur pronostique simple permettait dans cette
étude de séparer deux groupes de patients en fonc-
tion de la tension artérielle (TA) diastolique sous
traitement : la SG des patients avec au moins une
mesure de la TA diastolique supérieure ou égale à
90 mmHg était de 13 mois, alors qu’elle n’était que
de 6,2 mois chez les patients avec TA diastolique
inférieure à 90 mmHg. Sur un plan plus biologique,
une diminution du VEGFR-2 et du VEGFR-3 solubles
ainsi qu’une augmentation du VEGF sérique étaient
observées sous traitement. Les études ultérieures
devront confirmer le bénéfice de cette molécule en
fonction de ces éléments.
Facteurs prédictifs de réponse au traitement ◆
La valeur pronostique et prédictive de la TA dias-
tolique a fait l’objet d’une étude spécifique trans-
versale rétrospective réalisée à partir des résultats
de 6 études de phase II évaluant l’efficacité anti-
tumorale de l’axitinib à la dose de 5 mg x 2/ j sur
307 patients traités pour un mélanome (n = 32), un
cancer du pancréas (n = 69), du rein (n = 52), de la
thyroïde (n = 60) ou du poumon non à petites cellules
(n = 32) [17]. Une mesure de la TA était effectuée au
moins toutes les 4 semaines. Cent cinquante-huit
des 298 patients évaluables (51,5 %) ont eu au moins
une fois une TA diastolique ≥ 90 mmHg. La SG était
augmentée dans les 6 études chez les patients avec
une valeur de TA diastolique ≥ 90 mmHg constatée
au moins une fois, comparée à celle des patients dont
la TA diastolique était constamment inférieure à
90 mmHg (globalement 22,2 mois versus 9,1 mois) ;
la survie était plus que double dans le cas du cancer
du pancréas (13 mois versus 5,6 mois) et du méla-
nome (13 mois versus 6,4 mois). L’analyse poolée
des 6 études selon un modèle de Cox montre un
hazard-ratio (HR) de 0,493 (p < 0,001), et l’analyse
séparée de chacune des études montre une diffé-
rence de survie significative uniquement dans la
population de patients atteints du cancer du rein,
mais les effectifs étaient faibles. En termes de taux
de RO, la différence était également globalement
significative, en faveur des patients avec HTA dias-
tolique (36,1 % versus 7,9 % ; p < 0,001), surtout
en cas de cancer du rein. Au total, l’évolution de la
TA diastolique sous traitement par axitinib semble
être un facteur prédictif et pronostique pertinent,
qui mérite toutefois d’être confirmé comme tel dans
de futures études de phase III.
Conclusion
L’ASCO 2008 confirme l’intérêt et l’importance des
antiangiogéniques dans la stratégie thérapeutique de
plusieurs types de pathologies cancéreuses. Plusieurs
nouvelles molécules sont en cours d’évaluation et
semblent prometteuses en raison de l’absence de
résistance croisée avec les antiangiogéniques de
première génération. De gros efforts restent à faire
pour notamment :
augmenter la pertinence des critères d’effica-
➤
cité de ces molécules, puisque les critères RECIST
sont généralement peu adaptés aux traitements
antiangiogéniques, qui peuvent provoquer une
nécrose tumorale sans que le volume tumoral à
l’imagerie soit diminué de façon significative. Des
méthodes d’imagerie fonctionnelle sont à l’étude
pour permettre d’évaluer plus finement les effets
précoces des antiangiogéniques sur la vascularisation
des tumeurs ;
mettre en évidence des facteurs prédictifs clinico-
➤
biologiques d’efficacité de ces molécules adaptés aux
mécanismes d’action et au comportement biolo-
gique de la tumeur ;
approfondir les connaissances sur la physiopatho-
➤
logie des effets indésirables spécifiques de ces trai-
tements pour mieux les soigner et les prévenir ;
connaître les mécanismes de résistance grâce
➤
notamment à la réalisation systématique de prélè-
vements biopsiques séquentiels de la tumeur.
 6
6
1
/
6
100%