Thérapies ciblées et cancer du rein : autour de cas cliniques

CAS CLINIQUE
La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008 | 329
Thérapies ciblées et cancer du rein :
autour de cas cliniques
C. Massard*, I. Chapelle**
E
n France, l’incidence du cancer du rein a été estimée
en 2000 à 8 300 nouveaux cas, ce qui représente 3 %
des cancers (tableau I) [1]. En vingt ans, l’augmentation
enregistrée est de 2,7 % chez l’homme et de 3,7 % chez la femme
(1). Dans la majorité des cas (75 %), il s’agit de cancers à cellules
claires.
Le cancer du rein métastatique a longtemps été considéré comme
résistant à la plupart des traitements. Pendant de nombreuses
années, la prise en charge était fondée sur la néphrectomie et sur
l’utilisation de l’immunothérapie (interleukine 2 [IL-2], interféron α
[IFNα]), souvent toxique et faiblement efficace (tableau I) [2].
Les nouvelles approches thérapeutiques ciblées ont permis
d’améliorer le temps jusqu’à progression (TTP) du cancer du
rein méta statique (tableau II). Parmi les nouveaux concepts
développés, on retrouve des molécules ciblant les différents
éléments intrinsèquement liés à la physiopathogénie du cancer
du rein :
➤ Les inhibiteurs multikinases, petites molécules ciblant les
récepteurs du VEGF (sorafénib, sunitinib) ;
➤ Les anticorps monoclonaux anti-VEGF (bévacizumab) ;
➤ Les inhibiteurs de mTOR (temsirolimus, évérolimus).
Plusieurs facteurs vont influencer le choix du traitement :
➤ des facteurs liés aux patients tels que l’état général, l’âge, la
fonction rénale et le risque cardiaque ;
➤ la tolérance des traitements, puisque les différentes molécules
disponibles ont des profils de tolérance différents ;
➤ les traitements reçus antérieurement, en tenant compte des
éventuels échecs thérapeutiques.
Tableau II. Les thérapies ciblées enregistrées en France.
DCI Nom commercial Laboratoire AMM Indication Doses
Sorafénib Nexavar®Bayer-Schering Pharma 2006 Cancer du rein métastatique 400 mg p.o. matin et soir en continu
Sunitinib Sutent®Pfizer 2006 Cancer du rein métastatique 50 mg/j p.o. pendant 4 semaines,
toutes les 6 semaines
Bévacizumab Avastin®Roche 2007 Cancer du rein métastatique
en association avec l’interféron
10 mg/kg/sem. i.v.
Temsirolimus Torisel®Wyeth 2008 Cancer du rein métastatique
de mauvais pronostic
25 mg/sem. i.v.
Tableau I. Le cancer du rein : quelques chiffres.
En France
(1)
Pourcentage au sein des cancers (%) 3
Incidence en 2000 8 300 nouveaux cas
Augmentation en 20 ans
Chez l’homme (%)
Chez la femme (%)
+ 2,7
+ 3,7
Mortalité à 1 an avant les antiangiogéniques
(2)
Forme localisée (%) 2,9
Avec envahissement ganglionnaire (%) 16,3
Stade métastatique (%) 67,8
* Service d’oncologie, institut Gustave-Roussy, Villejuif.
** Châtenay-Malabry.

CAS CLINIQUE
00 4 6 10 122 8
Placebo
Sorafénib
SSP médiane
Sorafénib (n = 384) : 5,5 mois
Placebo (n = 385) : 2,8 mois
HR = 0,44
IC ₉₅ : 0,35 - 0,55
p < 0,001
Temps depuis la randomisation (mois)
14
25
75
100
A B
Survie sans progression (% patients)
50
0
25
75
100
Survie globale (% patients)
50
0 4 12 16 20 24 28 32 36 408
Temps depuis la randomisation (mois)
Sorafénib (n = 451) : 17,8 mois
Placebo (n = 452) : 14,3 mois
HR (sorafénib/placebo) = 0,78
IC ₉₅ : 0,62 - 0,97
p = 0,0287
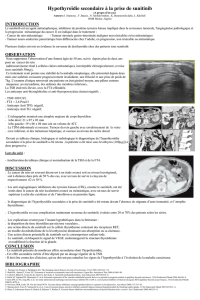
Figure 1. Sorafénib versus placebo en deuxième ligne métastatique du cancer du rein : amélioration de la survie sans progression (A) et de la survie
globale (B) [3, 4].
330 | La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008
Cas clinique n° 1 :
que faire après échec des cytokines ?
Histoire de la maladie
Une tumeur du rein droit de 4 cm est découverte en juin 1995
chez un homme âgé de 61 ans, ayant des antécédents d’hypo-
thyroïdie et une valve cardiaque sur rhumatisme articulaire aigu.
Le patient est opéré par néphrectomie avec un stade pT1N0M0
Fuhrman 3.
En décembre 2002, des métastases pulmonaires multiples appa-
raissent, non accessibles à un traitement chirurgical. L’état général
du patient est bon. Seule l’immunothérapie étant disponible à
cette période, un traitement par IFN est instauré pendant 9 mois,
qui permet une régression des lésions pulmonaires. Le patient est
suivi régulièrement.
En janvier 2005, la maladie progresse, avec apparition d’un
nodule du pancréas, d’un nodule surrénalien gauche, de lésions
pulmonaires, d’un nodule hépatique et d’un ganglion inter aortico-
cave.
Choix thérapeutiques après échec
des cytokines
Sorafénib
Le sorafénib, inhibiteur multikinase, a été la première molécule
ciblée développée dans le cancer du rein en deuxième ligne méta-
statique après échec de l’immunothérapie. Comparé à un placebo
dans une étude randomisée de phase III, le sorafénib améliore de
56 % la survie sans progression (SSP) [hazard-ratio (HR) = 0,44 ;
p = 0,001] et de 22 % la survie globale (SG) [HR = 0,78 ; p = 0,0287]
(figure 1) [3, 4].
Sunitinib
Le sunitinib a un mécanisme d’action et des cibles similaires à ceux
du sorafénib au niveau du VEGFR et du PDGFR. Cependant, il existe
certaines différences dans la mesure où le sorafénib agit également
sur la voie raf intracellulaire. Comparé à l’IFN en première ligne
métastatique, le sunitinib a permis un gain de SSP de 6 mois (5).
Après échec de l’immunothérapie, les résultats des études de
phase II montrent une SSP de l’ordre de 8 mois (6, 7).
Bévacizumab
Le bévacizumab, anticorps monoclonal anti-VEGF, administré
après échec des cytokines, permet une SSP de 4,8 mois (8). En
première ligne métastatique, il a été développé en association
avec l’IFN, induisant une amélioration de la SSP par rapport à
l’IFN seul (10,2 mois versus 5,4 mois) [9].
Choix thérapeutique chez ce patient
Le sorafénib est la seule molécule disposant d’un niveau de
preuve suffisant en deuxième ligne après échec des cytokines.
Il constitue dans cette situation l’option préférentielle si l’on se
réfère aux algorithmes thérapeutiques (tableau III). Le patient
reçoit donc du sorafénib 400 mg x 2/j en continu et présente
des images de nécroses tumorales avec une stabilisation de la
maladie.

CAS CLINIQUE
La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008 | 331
Cas clinique n° 2 :
prise en charge des effets indésirables
des inhibiteurs multikinases
Histoire de la maladie
Des métastases pulmonaires et ganglionnaires d’un cancer du
rein sont découvertes d’emblée chez un homme âgé de 55 ans
sans antécédents. Le patient est mis sous sunitinib, à raison de
50 mg/j pendant 4 semaines toutes les 6 semaines.
À J15, son performance status (PS) est de 0, sa tension artérielle
(TA) systolique/diastolique est de 12/8 mmHg et son pouls est
de 82 battements/mn.
On ne relève pas de toxicité digestive ni cutanée, et le bilan
bio logique est normal.
À J28, le PS est de 0, la TA de 21/11 mmHg et le pouls de 90 batte-
ments/mn. Parallèlement, le patient présente des épistaxis, une
mucite et une diarrhée.
La thyréostimuline (TSH) atteint 22 mU/l.
Prise en charge de la toxicité
La toxicité cardiovasculaire est un effet de classe des antiangio-
géniques. L’hypertension artérielle (HTA) est l’effet indésirable
le plus fréquemment observé, et les mécanismes n’en sont pas
encore totalement élucidés (10). Le traitement standard de cette
HTA secondaire aux antiangiogéniques est fondé sur les inhibiteurs
calciques (le vérapamil et le diltiazem, qui utilisent les mêmes cyto-
chromes que certains anti-VEGF et peuvent ainsi les potentialiser,
sont à éviter), les inhibiteurs de l’enzyme de conversion (IEC) et
les diurétiques. Les autres effets cardiovasculaires observés sont
des atteintes thrombo-emboliques veineuses ou artérielles, des
troubles du rythme et des insuffisances cardiaques.
L’hypothyroïdie est une toxicité observée plus fréquemment avec
le sunitinib (11, 12) ; elle reste rare avec le sorafénib (13). Elle est
d’apparition assez brutale et précoce. Il est donc nécessaire de
procéder à une surveillance biologique de la fonction thyroïdienne
par dosage de la TSH face à des signes cliniques d’appel tels que
l’asthénie. La prise en charge consiste en un traitement substitutif
après consultation d’endocrinologie.
Prise en charge chez ce patient
Après 6 cycles, le patient a une TA équilibrée sous nicardipine
(Loxen®) et telmisartan (Pritor®). La mucite est améliorée par
des bains de bouche. La diarrhée est contrôlée par un traitement
symptomatique par lopéramide. La TSH est normalisée avec de
la lévothyroxine.
Cas clinique n° 3 :
les séquences thérapeutiques
Histoire de la maladie
En août 2004, un homme âgé de 46 ans, sans antécédents notables,
subit une néphrectomie radicale pour un adénocarcinome rénal à
cellules claires classé T2 grade 3. En avril 2005, il développe des
métastases pulmonaires et des adénopathies rétropéritonéales,
avec conservation de l’état général. Il est traité par l’association
bévacizumab-IFN, ce choix se fondant sur les résultats de l’étude
AVOREN (8). En septembre 2005, la maladie progresse.
Séquences thérapeutiques possibles
Après bévacizumab
Les options thérapeutiques reposent sur les inhibiteurs multi-
kinases, que ce soit le sorafénib ou le sunitinib (14, 15). Les résultats
obtenus avec cette séquence tendent à montrer que les inhibiteurs
multikinases sont capables d’inhiber les voies de signalisation
impliquées dans le processus de résistance au bévacizumab, sans
que ce mécanisme soit aujourd’hui élucidé.
Après inhibiteurs multikinases
Il ne semble pas y avoir de résistance croisée entre les deux inhi-
biteurs multikinases, ce qui permet de faire indifféremment une
séquence sorafénib-sunitinib ou sunitinib-sorafénib (16). Notons
toutefois qu’une durée de réponse plus longue a été décrite dans
la séquence sorafénib suivi de sunitinib (17).
Inhibiteurs de mTOR
Le temsirolimus (25 mg/sem. i.v.) appartient à la nouvelle classe
thérapeutique des inhibiteurs de mTOR. Il a montré sa supério-
Tableau III. Algorithme thérapeutique dans la prise en charge du cancer du rein métastatique.
Ligne thérapeutique Pronostic Recommandations Options
Patients non prétraités (première ligne)
Bon ou intermédiaire Sunitinib
Bévacizumab + IFN ?
IL-2 haute dose
Sorafénib ?
Mauvais Temsirolimus
Sunitinib
Sorafénib ?
Patients réfractaires (deuxième ligne)
Échec des cytokines Sorafénib Sunitinib
Échec des anti-VEGF/VEGFR
ou des inhibiteurs de mTOR
Pas de résultats Traitement séquentiel par TKI ou anti-VEGF
IFN : interféron ; IL-2 : interleukine 2 ; VEGF :
vascular endothelial growth factor
; VEGFR :
vascular endothelial growth factor receptor
; TKI :
tyrosine kinase inhibitor
.

CAS CLINIQUE
Revue centralisée
Revue investigateurs 0,30 410
HR
Bénéfice de l'évérolimus Bénéfice du placebo
Risque MSKCC
Favorable
Intermédiaire
Défavorable
0,35
0,25
0,39
118
231
61
Traitement antérieur
Sorafénib seul
Sunitinib seul
Sorafénib + sunitinib
0,29
0,30
0,28
119
184
107
Âge
< 65 ans
≥ 65 ans
0,32
0,29
Sexe
Masculin
Féminin
0,29
0,36
Région
États-Unis et Canada
0 0,2 0,4 0,6
Hazard-ratio
0,8 1,0 1,2 1,4
Europe
Japon et Australie
0,24
0,37
0,10
259
151
317
93
130
251
29
n
Figure 2. Évérolimus après échec des inhibiteurs multikinases : le
bénéfice en termes de survie sans progression est identique, quel
que soit le nombre de lignes de traitement (19).
332 | La Lettre du Cancérologue • Vol. XVII - n° 7 - septembre 2008
rité par rapport à l’IFN dans une étude de phase III randomisée
portant sur des patients de mauvais pronostic ou de pronostic
intermédiaire, avec une médiane de SG de 10,9 mois en première
ligne méta statique (18). Après échec des inhibiteurs multikinases,
l’évérolimus (RAD 001) prolonge significativement la SSP, que ce
soit après sorafénib, après sunitinib ou après les deux molécules,
sachant que la majorité des patients avaient reçu au moins deux
lignes thérapeutiques antérieures (tableau IV) [19]. Le bénéfice de
l’évérolimus est similaire, que les patients aient reçu un ou deux
inhibiteurs multikinases (figure 2) [19]. Ce traitement permet
ainsi de disposer d’une molécule supplémentaire dans les lignes
thérapeutiques.
1. Remontet L, Esteve J, Bouvier AM et al. Cancer incidence and mortality in France over
the period 1978-2000. Rev Epidemiol Sante Publique 2003;51:3-30.
2. National Cancer Institute. SEER cancer statistics review 1975-2001. Bethesda, MD,
NCI, 2004.
3. Escudier B, Eisen T, Stadler WM et al. Sorafenib in advanced clear-cell renal-cell
carcinoma. N Engl J Med 2007;356:125-34.
4. Bukowski R, Eisen T, Szczylik C et al. J Clin Oncol 2007;(Suppl. 18): abstract 5023.
5. Motzer RJ, Hutson TE, Tomczak P et al. Sunitinib versus interferon alfa in metastatic
renal-cell carcinoma. N Engl J Med 2007;356:115-24.
6. Motzer RJ, Michaelson MD, Redman BG et al. Activity of SU11248, a multitargeted
inhibitor of vascular endothelial growth factor receptor and platelet-derived growth
factor receptor, in patients with metastatic renal cell carcinoma. J Clin Oncol 2006;24:16-
24.
7. Motzer RJ, Rini BI, Bukowski RM et al. Sunitinib in patients with metastatic renal cell
carcinoma. JAMA 2006;295:2516-24.
8. Yang JC, Haworth L, Sherry RM et al. A randomized trial of bevacizumab, an anti-
vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med
2003;349:427-34.
9. Escudier B, Koralewski P, Pluzanska A et al. A randomized, controlled, double-blind
phase III study (AVOREN) of bevacizumab/interferon-α2a vs placebo/interferon-α2a
as first-line therapy in metastatic renal cell carcinoma. J Clin Oncol 2007;25(Suppl. 18):
abstract 3.
10. Izzedine H. Angiogenesis inhibitor therapies: focus on hypertension and kidney
toxicity. Bull Cancer 2007;94:981-6.
11. Rini BI, Tamaskar I, Shaheen P et al. Hypothyroidism in patients with metastatic renal
cell carcinoma treated with sunitinib. J Natl Cancer Inst 2007;99:81-3.
12. Desai J, Yassa L, Marqusee E et al. Hypothyroidism after sunitinib treatment for
patients with gastrointestinal stromal tumors. Ann Inter Med 2006;145:660-4.
13. Tamaskar I, Bukowski R, Elson P et al. Thyroid function test abnormalities in patients
with metastatic renal cell carcinoma treated with sorafenib. Ann Oncol 2008;19:265-8.
14. Tamaskar I, Shaheen P, Wood L et al. Antitumor effects of sorafenib and sunitinib in
patients (pts) with metastatic renal cell carcinoma (mRCC) who had prior therapy with
anti-angiogenic agents. J Clin Oncol 2006;24(Suppl. 18): abstract 4597.
15. Rini BI, George DJ, Michaelson MD et al. Efficacy and safety of sunitinib malate
(SU11248) in bevacizumab-refractory metastatic renal cell carcinoma (mRCC). J Clin
Oncol 2006;24(Suppl. 18): abstract 4522.
16. Sablin MP, Bouaita L, Balleyguier C et al. Sequential use of sorafenib and sunitinib
in renal cancer: retrospective analysis in 90 patients. J Clin Oncol 2007;25(Suppl. 18):
abstract 5038.
17. Dhan A, Dudek AZ. Sequential therapy with sorafenib and sunitinib in renal cell
carcinoma. J Clin Oncol 2007;25(Suppl. 18): abstract 5106.
18. Hudes G, Carducci M, Tomczak P et al. Global ARCC Trial. Temsirolimus, interferon
alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007;356:2271-81.
19. Motzer R, Escudier B, Oudard S et al. RAD001(everolimus) plus best supportive care
(BSC) vs BSC plus placebo in patients with metastatic renal cell carcinoma (RCC) after
progression on VEGFR-TKI therapy. J Clin Oncol 2008;26(Suppl. 15): abstract LBA 5026.
20. Amato RJ, Harris P, Dalton M et al. A phase II trial of intra-patient dose-escalated
sorafenib in patients (pts) with metastatic renal cell cancer (MRCC). J Clin Oncol
2007;25(Suppl. 18): abstract 5026.
21. Szczylik C, Demkow T, Staehler M et al. Randomized phase II trial of first-line treatment
with sorafenib versus interferon in patients with advanced renal cell carcinoma: final
results. J Clin Oncol 2007;25(Suppl. 18): abstract 5025.
Références bibliographiques
Tableau IV. Traitements antérieurs.
Précédent traitement avec TKI de l’EGFR
Sunitinib seul 124 (46 %) 60 (43 %)
Sorafénib seul 77 (28 %) 42 (30 %)
Sunitinib et sorafénib 71 (26 %) 36 (26 %)
Autre thérapie systémique antérieure
Interféron 138 (51 %) 72 (52 %)
Interleukine 2 60 (22 %) 33 (24 %)
Chimiothérapie 36 (13 %) 22 (16 %)
Bévacizumab 24 (9 %) 14 (10 %)
Chirurgie antérieure (néphrectomie) 262 (96 %) 131 (95 %)
Radiothérapie antérieure 83 (31 %) 38 (28 %)
Choix thérapeutique chez ce patient
Le patient reçoit 37, 5 mg/j de sunitinib en continu. En février 2006,
la maladie progresse, avec augmentation des lésions pulmonaires et
rechute locale. En mars, un traitement par sorafénib 400 mg x 2/ j
est instauré. En septembre, la maladie progresse et les doses de
sorafénib sont augmentées, passant à 600 mg x 2/j sur les bases
de l’effet-dose décrit avec cette molécule (20, 21). En février 2007,
la maladie progresse à nouveau avec altération de l’état général,
et le patient reçoit un traitement par évérolimus dans le cadre
d’un essai clinique (19). ■
1
/
4
100%