Toxicité des antiangiogéniques (bévacizumab, sunitinib,

Soins de support en oncologie
Soins de support en oncologie
191
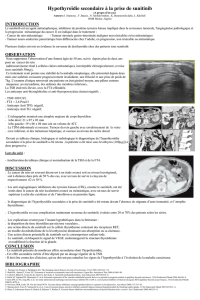
Tableau.
Incidence des e ets indésirables les plus fréquents du béva-
cizumab, du sunitinib et du sorafenib.
Tous grades ;
gr. 3-4 (%)
Bévacizumab Sunitinib Sorafenib
Cardiaque
Hypertension 22 à 32 ; 11 à 16 5 à 24 ; 5 à 8 17 à 43 ; 4 à 31
Thrombose artérielle 3,8 - -
Diminution FEVG - 10 ; 2 -
Symptômes généraux
Asthénie - 51 ; 7 37 ; 5
Gastro-intestinal
Diarrhées - 53 ; 5 43 ; 2
Nausées - 44 ; 3 23 ; 1
Mucite - 20 ; 2 -
Cutanée
Rash/
desquamation - 19 ; 2 40 ; 1
Syndrome mains/pieds - 20 ; 5 30 ; 6
Hématologique
Anémie - 71 ; 4 8 ; 3
Thrombopénie - 65 ; 8 -
La Lettre du Cancérologue - Vol. XVI - n° 5 - mai 2007
Toxicité des antiangiogéniques (bévacizumab, sunitinib,
sorafenib) : état des connaissances et attitudes pratiques
Toxicity of antiangiogenic (bevacizumab, sunitinib, sorafenib): sumary and clinical
practice management
●● S. Oudard, J. Medioni, A. Chedid, E. Banu, D. Dionysopoulos, J. Balcaceres, F. Scotté*
* Service de cancérologie médicale, hôpital européen Georges-Pompidou, université René-
Descartes, Paris-V.
L’
angiogenèse est essentielle pour la croissance tumo-
rale et l’évolution métastatique des cellules tumorales.
L’inhibition de la croissance de ces néovaisseaux qui
alimentent la tumeur est depuis peu possible avec l’arrivée des
antiangiogéniques bloquant soit le VEGF (Vascular Endothelial
Growth Factor) soit les récepteurs VEGF (sunitinib, sorafenib,
etc.). Le bévacizumab est la première molécule antiangiogénique
développée en cancérologie. Ces agents s’accompagnent de
bénéfi ces importants en termes de survie globale. Cependant, un
certain nombre d’eff ets indésirables sont observés, dont certains
sont classe-dépendants, et il est nécessaire de les connaître afi n
de les prévenir ou de les contrôler au mieux.
INDICATIONS THÉRAPEUTIQUES ET MODALITÉS
D’ADMINISTRATION
Le bévacizumab en association avec la chimiothérapie a obtenu
l’autorisation de mise sur le marché (AMM) dans le cancer
métastatique du côlon en démontrant un avantage en termes
de survie globale. Le sunitinib a obtenu l’AMM dans le cancer
du rein métastatique en première ligne et les GIST en cas d’in-
tolérance ou de résistance à l’imatinib. Le sorafenib a obtenu
l’AMM dans le cancer du rein métastatique en cas de contre-
indication de l’immunothérapie.
Concernant les modalités d’administration :
le bévacizumab doit être prescrit à la dose de 5 mg/kg en
perfusion i.v. toutes les deux semaines ;
le sorafenib est administré à la dose de 400 mg matin et soir
par voie orale sur un mode continu, soit une heure avant le
repas, soit deux heures après. En cas de mauvaise tolérance, une
réduction de dose est nécessaire à 400 mg dose totale ;
le sunitinib est donné à la dose de 50 mg par jour par voie
orale pendant quatre semaines puis deux semaines de repos.
En cas de mauvaise tolérance, une réduction de dose à 37,5 mg
est nécessaire. En deçà de 25 mg, cet antiangiogénique n’est
pas actif.
REVUE BIBLIOGRAPHIQUE DES TOXICITÉS CLINIQUES
DES PRINCIPAUX ANTIANGIOGÉNIQUES
Le tableau liste l’ensemble des effets indésirables les plus
fréquents du bévacizumab, du sunitinib et du sorafenib.
Toxicité cardiovasculaire
L’hypertension artérielle (HTA) est un des eff ets indésirables
les plus fréquents des antiangiogéniques. L’HTA est défi nie
par une augmentation de la pression artérielle (PA) au-dessus
de 140/90 mmHg. Le programme d’évaluation des traitements
contre le cancer (CTEP), en association avec le National Cancer
Institute, a élaboré des grades de toxicité et la nécessité d’intro-

Soins de support en oncologie
Soins de support en oncologie
192
La Lettre du Cancérologue - Vol. XVI - n° 5 - mai 2007
duire des traitements antihypertenseurs s’il existe une élévation
de plus de 20 mmHg de la PA ou une PA systolique supérieure
ou égale à 150 mmHg. Cette HTA, souvent modérée, survient
généralement dans les premières semaines de traitement et est
réversible à l’arrêt de celui-ci.
Le mécanisme physiopathologique n’est pas complètement
élucidé. La perfusion de VEGF s’accompagne d’une hypotension
par le biais de l’activation de la NO-synthétase endothéliale
et de la production de monoxyde d’azote (NO) ayant un eff et
vasodilatateur. L’inhibition du VEGFR entraîne l’eff et inverse
responsable d’une augmentation de la PA. La raréfaction capil-
laire pourrait jouer un rôle dans le développement de l’HTA, car
elle a été observée chez les patients après 6 mois de traitement
par bévacizumab (1).
L’incidence de l’HTA avec le bévacizumab dans les essais sur le
cancer du côlon en association avec la chimiothérapie est de 22 à
32 %, avec 11 à 16 % de toxicité grade 3 (2). Il semblerait exister
un eff et-dose avec une incidence tous grades confondus de 28 %
à 10 mg/kg de bévacizumab versus 11 % à 5 mg/kg (3). Tous les
cas d’HTA étaient contrôlés par un traitement antihypertenseur
standard. Le recours à un traitement semble toucher environ 10 à
15 % des patients recevant le bévacizumab. Ces traitements font
appel aux inhibiteurs de l’enzyme de conversion, aux antagonistes
des récepteurs de l’angiotensine 2 (ARA2), aux diurétiques et aux
bêtabloquants. Concernant le sorafenib, l’incidence est de 17 à
43 %, avec 4 à 31 % de grade 3-4 (4, 5). Un traitement antihyper-
tenseur était nécessaire chez 46 % de ces patients. Une analyse
plus précise de la PA a été réalisée chez 20 patients traités avec
le sorafenib et démontre une augmentation précoce de la PA
systolique, après seulement trois semaines, de 10 et 20 mmHg
chez 75 % et 60 % des patients respectivement (6). Cette petite
étude n’a pas permis d’élucider le mécanisme physiopatholo-
gique de cette HTA liée au sorafenib. Concernant le sunitinib,
l’incidence est de 5 à 24 %, avec 5 à 8 % de grade 3 d’après les
études de phase II et III dans le cancer du rein (7, 8). S’agissant
d’un traitement discontinu (50 mg p.o., quatre semaines sur six),
cette HTA est notée pendant la phase de traitement et diminue
pendant la phase de repos (9). Si un traitement antihyperten-
seur est mis en place en raison d’une HTA liée au sunitinib,
pendant la phase de repos, ce traitement pourra être diminué.
Le sorafenib et le sunitinib sont métabolisés par le cytochrome
CYP3A4 et requièrent comme traitement antihypertenseur des
molécules sans interférence avec ce cytochrome comme les
IEC, les ARA2, les diurétiques et les bêtabloquants. Les inhi-
biteurs calciques sont des inhibiteurs du cytochrome CYP3A4
et doivent être évités.
Les événements à type de thrombose artérielle (accident vascu-
laire cérébral, accident ischémique transitoire, infarctus du
myocarde, angor et hémorragie cérébrale) semblent être plus
fréquents avec l’association bévacizumab + chimiothérapie par
rapport à la chimiothérapie seule (3,8 % versus 1,7 %) à partir
de l’analyse cumulée de 5 essais randomisés (10). Ce risque ne
semble pas exister avec le sunitinib et le sorafenib. L’utilisation
des traitements anticoagulants ne semble pas être associée à
une majoration du risque de saignements (11).
Une insuffi sance cardiaque avec diminution de la fraction d’éjec-
tion ventriculaire gauche (FEVG) a pu être observée avec le
sunitinib dans 10 % des cas, avec 2 à 4 % de grade 3-4. Une
évaluation de la FEVG est recommandée tous les deux cycles
avec le sunitinib chez les patients présentant des comorbidités
cardiovasculaires (12).
Des épistaxis sont fréquemment retrouvées avec le sunitinib
et le sorafenib. Des soins locaux par méchage peuvent s’avérer
utiles.
Toxicité rénale
L’incidence de la protéinurie dans les essais associant bévaci-
zumab + chimiothérapie dans les cancers coliques est de 22 à
38 % (11 à 21 % avec la chimiothérapie seule). Aux doses utilisées
pour le bévacizumab, la protéinurie est souvent asymptomatique
et généralement associée à une HTA. Cependant, en cas de
protéinurie supérieure ou égale à 2 g/24 heures, le traitement doit
être interrompu. Des cas de microangiopathies ont été rapportés
avec le sunitinib (13). Une insuffi sance rénale, une chute de
l’haptoglobine et la présence de schizocytes sont évocatrices de
ce tableau clinique et doivent faire arrêter ce traitement.
Asthénie et hypothyroïdie
L’asthénie est une plainte fréquente chez les patients traités
par le sunitinib (51 % tous grades confondus, 7 % grade 3-4) et
le sorafenib (37 % tous grades confondus, 5 % grade 3-4) ; son
impact sur la qualité de vie nécessite de temps en temps des
réductions de dose de ces antiangiogéniques, voire un arrêt
transitoire du traitement. Cette asthénie est multifactorielle et
doit faire rechercher une anémie à traiter et/ou une hypothy-
roïdie d’installation progressive.
Une hypothyroïdie a été notée chez des patients atteints d’un
GIST ou d’un cancer du rein métastatique et traités avec le
sunitinib (14, 15). Le risque d’apparition de l’hypothyroïdie est
corrélé à la durée du traitement. À partir de ces soixante-cinq
pour cent, 108 patients ont présenté une anomalie biologique
du bilan thyroïdien. L’élévation de la TSH précède les signes
cliniques et un traitement de substitution permet d’améliorer
l’hypothyroïdie dans 50 % des cas. Dès lors, il est recommandé
de doser régulièrement les hormones thyroïdiennes.
Toxicité digestive
L’anorexie, la dysgueusie et la perte de poids peuvent être obser-
vées avec le sorafenib et le sunitinib. Elles vont avoir un retentis-
sement direct sur l’asthénie et la qualité de vie du patient. Une
consultation en diététique peut être utile, ainsi qu’un régime
hypercalorique.
La mucite, diff érente des mucites rapportées avec la chimio-
thérapie, correspond à une sensation d’irritation ou de brûlure
linguale ou des gencives, rarement accompagnée d’ulcérations.
La mucite est plus souvent rapportée avec le sunitinib (25 %
tous grades confondus, 1 % de grade 3-4). Des bains de bouche
sont préconisés en préventif (bicarbonates NaCl 1,4 % : 400 cc,
nystatine : un fl acon ; chlorhexidine : 3 cuillerées à soupe).
La diarrhée est fréquente avec le sorafenib et le sunitinib, respec-

Soins de support en oncologie
Soins de support en oncologie
193
La Lettre du Cancérologue - Vol. XVI - n° 5 - mai 2007
tivement de 43 % et 53 % tous grades confondus, avec moins
de 5 % de grade 3-4. Un traitement préventif est proposé systé-
matiquement aux patients, et il peut être indiqué de préconiser
des antidiarrhéiques avant chaque repas en cas de diarrhée
rebelle.
Des perforations intestinales ont été rapportées avec le bévaci-
zumab (incidence : 1,5 %) et peuvent causer le décès du patient.
Dès lors, des douleurs abdominales associées à un syndrome
occlusif et à des vomissements doivent faire rechercher systéma-
tiquement une perforation digestive et faire arrêter le traitement
défi nitivement. Les patients à risque sont ceux qui présentent
une maladie tumorale très avancée avec un processus infl am-
matoire intra-abdominal associé.
Toxicité cutanée
La toxicité cutanée, extrêmement rare avec le bévacizumab,
s’observe avec le sorafenib et le sunitinib. On note principale-
ment une sécheresse cutanée, des rashs avec maculo-papules, un
prurit, des érythèmes cutanés. Un traitement préventif utilisant
des crèmes hydratantes est fortement recommandé (crème
émolliente, etc.). Il existe également des érosions bipolaires
buccales et périanales.
La décoloration des cheveux s’observe fréquemment avec le
sunitinib (inhibition de c-kit au niveau capillaire).
Un teint jaunâtre cutané périorbitaire est souvent révélateur de
l’imprégnation du sunitinib (16).
Le syndrome mains-pieds se voit préférentiellement avec le
sorafenib (30 % tous grades confondus, avec 6 % de grade 3-4).
Ce symptôme retentit souvent sur la qualité de vie du patient en
raison des douleurs à type de paresthésies au niveau des faces
palmaires des mains et plantaires des pieds, et empêche toute
marche prolongée. Des semelles orthopédiques, un traitement
à base de cystine B6 peuvent améliorer la symptomatologie. Il
est souvent nécessaire de diminuer les doses, voire d’arrêter le
traitement transitoirement.
Il semblerait que la toxicité cutanée observée avec le sora-
fenib, analysée à partir de quatre études de phase I portant sur
des tumeurs solides, soit associée à une meilleure survie sans
progression (17). Cela demande à être confi rmé à partir d’études
plus larges. Des hémorragies subunguéales ne s’accompagnant
d’aucun symptôme clinique ont été rapportées dans les essais
de phase I (18) et traduiraient le collapsus de microvaisseaux
périphériques.
Toxicité neurologique
Des cas d’encéphalopathie postérieure réversible ont été observés
avec les trois antiangiogéniques (19). Les manifestations cliniques
sont souvent majeures : céphalées incoercibles, cécité uni- ou
bilatérale, crises convulsives, hypertension intracérébrale, hyper-
signal cérébral postérieur à l’IRM. Ces symptômes disparaissent
à l’arrêt du traitement, qui doit être immédiat devant ce tableau
clinique. Ce syndrome de fuite capillaire cérébrale pourrait être dû
à une rupture de la barrière hémato-encéphalique et à un œdème
vasogénique de la substance blanche cérébrale liés à une altération
directe de l’endothélium cérébral et favorisés par une HTA.
PRISE EN CHARGE PRATIQUE DES TOXICITÉS
De façon systématique :
évaluation cardiovasculaire initiale ;
automesure de PA ;
recherche de protéinurie avant chaque cycle ;
bains de bouche ;
antidiarrhéiques ;
crème émolliente ;
savon surgras.
En cas d’asthénie :
rechercher une anémie à traiter avec supplémentation vita-
minique, folates, vitamine B12 ;
rechercher une hypothyroïdie à traiter avec opothérapie
substitutive par lévothyroxine quadrisécable 50 μg/j à adapter
à la TSH ;
consulter en diététique, avec alimentation équilibrée ;
consulter son médecin référent et discuter éventuellement
une réduction de dose.
En cas d’hypertension artérielle :
évaluer la FEVG avant le début du traitement chez les patients
ayant une comorbidité cardiovasculaire ;
rechercher une protéinurie (PTU) par une bandelette uri-
naire (BU),
si protéinurie supérieure à 2 croix, mesurer la protéinurie
des 24 heures ;
rechercher une dégradation de la fonction rénale (clairance
de la créatinine) ;
surveiller régulièrement la pression artérielle, privilégier
l’automesure ;
traiter l’HTA par les antihypertenseurs n’interférant pas avec
le CYP3A4,
privilégier les antihypertenseurs ayant un eff et antiprotéi-
nurique (IEC, ARA2) ;
utiliser les anti-VEGF prudemment en cas d’HTA non
contrôlée ;
les anti-VEGF doivent être arrêtés en cas de :
PTU supérieure à 2 g/24 heures,
syndrome néphrotique,
HTA sévère non contrôlée ;
arrêter ou diminuer les doses de sunitinib en cas de :
FEVG inférieure à 40 % ;
diminution de plus de 20 % par rapport à la FEVG de base ;
symptômes ou signes cliniques d’insuffi sance cardiaque
congestive ;
microangiopathie thrombotique (insuffi sance rénale, hapto-
globine basse, schizocytes, thrombopénie).
En cas de toxicité digestive :
traiter la diarrhée par lopéramide ± nifuroxazide ou par
racécadotril ;
traiter le refl ux gastrique par oméprazole + alginate de sodium
+ bicarbonate de sodium ;
✓
✓
✓
✓
✓
✓
•
✓
✓
✓
•
✓
✓
•
•
•
✓
•
•
•
•
✓
✓

Soins de support en oncologie
Soins de support en oncologie
194
Les articles publiés dans La Lettre du Cancérologue le sont sous la seule responsabilité de leurs auteurs.
Tous droits de reproduction, d’adaptation et de traduction par tous procédés réservés pour tous pays.
Edimark SAS © mai 1992 - Imprimé en Fance - Point 44 - 94500 Champigny-sur-Marne - Dépôt légal : à parution
Un “Infos Sympo” (12 pages) intitulé : “Nouvelle approche dans le traitement de la candidose oropharyngée :
un enjeu pour la prise en charge optimale du traitement carcinologique” est routé avec ce numéro.
La Lettre du Cancérologue - Vol. XVI - n° 5 - mai 2007
traiter les mucites avec préparation de bains de bouche :
bicarbonates NaCl 1,4 % : 400 cc, nystatine : un fl acon, chlorhexi-
dine : 3 cuillerées à soupe ;
traiter les fi ssures anales par carraghénates + dioxyde de
titane + oxyde de zinc + trimébutine + ruscogénines.
En cas de toxicité cutanée :
traiter la peau sèche par glycérol + vaseline + paraffi ne liquide
ou crème cuivre + zinc, éviter les savons irritants et les déodo-
rants, porter des vêtements amples ;
traiter le syndrome mains-pieds avec glycérol + vaseline +
paraffi ne liquide, cystine + pyridoxine, éviter les chaussures
fermées, proposer des semelles orthopédiques avec des zones
de décharge.
CONCLUSION
L’arrivée des antiangiogéniques marque un progrès indéniable
dans la prise en charge thérapeutique des tumeurs solides. Une
éducation précoce des patients et des traitements préventifs
doivent permettre de mieux gérer les toxicités de cette nouvelle
classe de molécules anticancéreuses. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Mourad J, Des Guetz G, Debbabi H, Levy B. Capillary rarefaction might
explain arterial hypertension in patients receiving bevacizumab. AHA 2007,
abstract 2585.
2. Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus irinotecan,
fl uorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med
2004;350(23):2335-42.
3. Kabbinavar F, Hurwitz HI, Fehrenbacher L et al. Phase II, randomized trial
comparing bevacizumab plus fl uorouracil (FU)/leucovorin (LV) with FU/LV
alone in patients with metastatic colorectal cancer. J Clin Oncol 2003;21(1):60-5.
4. Escudier B, Eisen T, Stadler WM et al. Sorafenib in advanced clear-cell renal-
cell carcinoma. N Engl J Med 2007;356(2):125-34.
✓
✓
✓
✓
5. Ratain MJ, Eisen T, Stadler WM et al. Phase II placebo-controlled rando-
mized discontinuation trial of sorafenib in patients with metastatic renal cell
carcinoma. J Clin Oncol 2006;24(16):2505-12.
6. Veronese ML, Mosenkis A, Flaherty KT et al. Mechanisms of hypertension
associated with BAY 43-9006. J Clin Oncol 2006;24(9):1363-9.
7. Motzer RJ, Hoosen S, Bello CL, Christensen JG. Sunitinib malate for the treat-
ment of solid tumours: a review of current clinical data. Expert Opin Investig
Drugs 2006;15(5):553-61.
8. Motzer RJ, Michaelson MD, Redman BG et al. Activity of SU11248, a multi-
targeted inhibitor of vascular endothelial growth factor receptor and platelet-
derived growth factor receptor, in patients with metastatic renal cell carcinoma.
J Clin Oncol 2006;24(1):16-24.
9. Chedid A, Bobrie G, Medioni J et al. Blood pressure increase in all patients given
sunitinib: a teletransmitted home blood pressure study. ESH 2007, abstract 1289.
10. Skillings JR, Johnson DH, Miller K et al. Arterial thromboembolic events in a
pooled analysis of 5 randomized, controlled trials of bevacizumab with chemo-
therapy. Proc Am Ass Clin Oncol USA 1981;23(abstract 3019):196s.
11. Hambleton J, Novotny WF, Hurwitz H et al. Bevacizumab does not increase
bleeding in patients with metastatic colorectal cancer receiving concurrent anti-
coagulation. Proc Am Ass Clin Oncol USA 2004;22(abstract 3528):14s.
12. Motzer RJ, Hutson TE, Tomczak P et al. Sunitinib versus interferon alfa in
metastatic renal-cell carcinoma. N Engl J Med 2007;356(2):115-24.
13. Frangie C, Lefaucheur C, Medioni J, Jacquot C, Hill GS, Nochy D. Renal
thrombotic microangiopathy caused by anti-VEGF-antibody treatment for
metastatic renal-cell carcinoma. Lancet Oncol 2007;8(2):177-8.
14. Desai J, Yassa L, Marqusee E et al. Hypothyroidism after sunitinib treat-
ment for patients with gastrointestinal stromal tumors. Ann Intern Med
2006;145(9):660-4.
15. Rini BI, Tamaskar I, Shaheen P et al. Hypothyroidism in patients with
metastatic renal cell carcinoma treated with sunitinib. J Natl Cancer Inst
2007;99(1):81-3.
16. Faivre S, Delbaldo C, Vera K et al. Safety, pharmacokinetic, and antitumor
activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients
with cancer. J Clin Oncol 2006;24(1):25-35.
17. Strumberg D, Awada A, Hirte H et al. Pooled safety analysis of BAY 43-9006
(sorafenib) monotherapy in patients with advanced solid tumours: Is rash asso-
ciated with treatment outcome? Eur J Cancer 2006;42(4):548-56.
18. Robert C, Soria JC, Spatz A et al. Cutaneous side-eff ects of kinase inhibitors
and blocking antibodies. Lancet Oncol 2005;6(7):491-500.
19. Glusker P, Recht L, Lane B. Reversible posterior leukoencephalopathy
syndrome and bevacizumab. N Engl J Med 2006;354(9):980-2.
1
/
4
100%