Cancer du rein métastatique : état des lieux des différentes lignes de

dossier thématique
Cancer du rein métastatique :
nouvelles molécules,
nouvelles stratégies
Correspondances en Onco-Urologie - Vol. III - no 2 - avril-mai-juin 2012
5050
Cancer du rein métastatique :
état des lieux des différentes lignes
de traitement
Medical treatment of metastatic renal cell carcinoma: state of the art
A. Thiery-Vuillemin*
* Service d’oncologie
médicale,
CHU de Besançon ;
Inserm, UMR1098,
Besançon ;
université de Franche-
Comté, UMR1098,
SFR IBCT, Besançon.
L
a prise en charge du cancer du rein s’est com-
plètement modifi ée en l’espace d’une dizaine
d’années grâce à une meilleure compréhension
des voies pro-oncogéniques, notamment de la voie
VHL-angiogenèse, avec pour résultat l’avènement des
thérapies ciblées. Celles-ci ont quasiment supplanté les
stratégies d’immunothérapie à base de cytokines dans
le traitement systémique du cancer du rein métasta-
tique. Actuellement, 2 classes thérapeutiques sont
particulièrement étudiées : les antiangiogéniques et
les inhibiteurs de mTOR. Le bévacizumab est le premier
antiangiogénique à avoir démontré son efficacité
dans le cadre d’une phase II randomisée, publiée en
2003 (1). Depuis, 5 molécules ont obtenu leur autori-
sation de mise sur le marché (AMM) dans le traitement
du cancer du rein métastatique et sont utilisées en
routine en France. Le tableau résume l’activité des
principales thérapies ciblées.
Traitements systémiques
de première ligne
Antiangiogéniques
Le sunitinib est un inhibiteur de tyrosine kinase
(ITK) antiangiogénique qui a démontré son activité
en première ligne de traitement du cancer du rein
méta statique à cellules claires dans une étude de
phase III randomisée qui le comparait à l’interféron
(IFN) α. La survie sans progression (SSP) et la survie
globale (SG) ont été signifi cativement meilleures avec
le sunitinib : 11 mois versus 5 mois et 26,4 mois versus
21,8 mois de médiane respectivement (2). Une étude
de phase II randomisée sur 292 patients retrouve
une tendance non signifi cative en faveur de l’admi-
nistration classique (4 semaines sur 6 à 50 mg) du
sunitinib par rapport à un schéma continu à 37,5 mg,
avec une médiane de SSP de 9,9 mois versus 7,1 mois
points forts
highlights
»
Les thérapies ciblées ont révolutionné la prise en charge du
cancer du rein métastatique.
»
Les 2 principales classes thérapeutiques sont les
antiangiogéniques et les inhibiteurs de mTOR.
»
La séquence optimale de traitement reste à défi nir, tout
comme la place de la néphrectomie avec l’étude CARMENA.
»
Les inhibiteurs de tyrosine kinases de deuxième génération
ont démontré des résultats positifs dans des études de phase
III.
»Les résultats des études adjuvantes sont attendus.
Mots-clés : Cancer du rein - Thérapies ciblées - Antiangiogéniques -
Inhibiteurs de mTOR - Séquences.
Targeted therapies have strongly modified the
management of metastatic renal cancer.
The 2 main therapeutic classes are antiangiogenics and
mTOR inhibitors.
The optimal sequence of treatment remains to be
precised, such as the place of nephrectomy with
CARMENA study.
Second-generation tyrosine kinase inhibitors have shown
positive results in phase III studies.
Results of adjuvant studies are strongly awaited.
Keywords: Renal cancer - Targeted therapies - Anti-
angiogenics - mTOR inhibitors - Sequence.

Correspondances en Onco-Urologie - Vol. III - no 2 - avril-mai-juin 2012
5151
Cancer du rein métastatique : état des lieux des diff érentes lignes de traitement
(p = 0,09) [3]. Le bévacizumab est la seule molécule à
avoir démontré un bénéfi ce signifi catif en termes de
SSP dans 2 études de phase III randomisées lorsqu’elle
est associée à l’IFNα, versus IFNα seul : études AVOREN
et CALGB 90206 (4, 5). Le sunitinib et le bévacizumab
étaient donnés à des patients présentant principalement
des cancers du rein métastatiques de pronostics bon et
intermédiaire. Entre 85 et 90 % des patients avaient subi
une néphrectomie. Récemment, une étude de phase II
incluant 147 patients présentant des caractéristiques
comparables à celles des malades de l’étude AVOREN
semble retrouver que la dose d’IFN α associé au bévaci-
zumab peut être réduite à 3 MUI, pour une médiane
de SSP de 14,8 mois jamais retrouvée par ailleurs en
première ligne (6).
Deux nouveaux antiangiogéniques émergent en
première ligne. Le pazopanib est un ITK qui a démontré
sa supériorité sur le placebo dans une étude de phase III
randomisée portant sur des patients avec cancer du
rein métastatique prétraités ou non par cytokine. La
courbe de SSP des 155 patients naïfs de traitement
systémique, avec une médiane de 11,1 mois, se
rapproche de celles du sunitinib ou du bévacizumab ;
le profi l de toxicité semble plus intéressant (7). Cela
a motivé une AMM européenne conditionnelle et
la réalisation de l’étude de phase III randomisée de
non-infériorité COMPARZ, comparant le pazopanib
et le sunitinib en première ligne. Le tivozanib est le
seul ITK à avoir démontré sa supériorité sur un autre
antiangiogénique, le sorafénib, lors de l’étude rando-
misée de phase III TIVO-1 (8). Les patients avaient
subi une néphrectomie et ne devaient pas avoir été
traités par antiangiogéniques ou inhibiteurs de mTOR
au préalable mais pouvaient avoir reçu une première
ligne de traitement systémique (cytokines). L’étude
a atteint son objectif principal : la médiane de SSP de
l’ensemble de la population est de 11,9 mois pour
le tivozanib versus 9,1 mois pour le sorafénib et de
12,7 mois versus 9,1 mois pour les patients naïfs de
tout traitement par cytokines. Le profi l de toxicité reste
voisin de celui des autres ITK antiangiogéniques. Ces
résultats ont été présentés au congrès américain en
cancérologie en 2012.
Inhibiteur de mTOR
La seule molécule à avoir démontré une activité
significative dans une étude de phase III chez des
patients avec cancer du rein métastatique de mauvais
pronostic est le temsirolimus. Cet inhibiteur de mTOR a
démontré une amélioration de la SG chez les patients
de mauvais pronostic par rapport à l’IFNα : médiane
de 10,9 mois versus 7,3 mois. À noter que 19 % des
patients avaient une histologie diff érente du classique
carcinome à cellules claires (9).
Deuxième ligne et au-delà
Auparavant, les patients recevaient un traitement
de première ligne à base de cytokine (interleukine 2
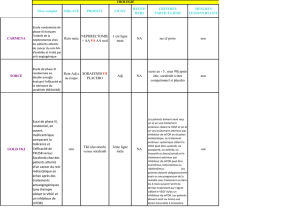
Tableau. Synthèse des principales études impliquant des thérapies ciblées dans le cancer du rein métastatique.
Type d’étude
Nombre
de patients
Patients
prétraités
Bras expérimental
SSP
(mois)
SG
(mois)
TR (%)
EscudierB et al.
Phase III randomisée
649
Non
Bévacizumab/interféron 9MUI
10,2
23,3
31,0
RiniBI et al.
Phase III randomisée
732
Non
Bévacizumab/interféron 9MUI
8,5
18,3
25,5
MelicharB et al.
Phase II non
randomisée
147
Non
Bévacizumab/interféron 3MUI
14,8
Non atteinte
24,3
MotzerRJ et al.
Phase III randomisée
750
Non
Sunitinib
11
26,4
31,0
MotzerRJ et al.
Press release
Phase III randomisée
517
Oui/non
Tivozanib
11,9
NR
NR
HudesG et al.
Phase III randomisée
626
Non
Temsirolimus
5,5
10,9
8,6
SternbergCN et al.
Phase III randomisée
233
Oui/non
Pazopanib
9,2
22,9
30,0
EscudierB et al.
Phase III randomisée
903
Oui
Sorafénib
5,5
17,8
10
MotzerRJ et al.
Phase III randomisée
416
Oui
Évérolimus
4,9
14,8
1,8
RiniBI et al.
Phase III randomisée
723
Oui
Axitinib
6,7
NR
19,0
NR : non rapportés ; SG : survie globale ; SSP : survie sans progression ; TR : taux de réponse.

dossier thématique
Cancer du rein métastatique :
nouvelles molécules,
nouvelles stratégies
Correspondances en Onco-Urologie - Vol. III - no 2 - avril-mai-juin 2012
5252
et/ou IFNα). Le sorafénib est un ITK antiangiogénique
qui a montré sa supériorité sur le placebo lors d’une
étude de phase III randomisée après cytokine (10).
Toutefois, la première ligne de traitement comporte le
plus souvent des antiangiogéniques. L’évérolimus est
un inhibiteur de mTOR qui a démontré une meilleure
SSP que le placebo (médiane : 4,9 mois versus 1,9 mois)
chez des patients avec un cancer du rein métastatique
ayant déjà reçu 1 ou 2 ITK antiangiogéniques (11).
Les ITK antiangiogéniques de deuxième génération
sont effi caces en deuxième ligne de traitement ; par
exemple, l’axitinib a une meilleure SSP que le soréfanib
(médiane : 6,7 mois versus 4,7 mois) chez des patients
ayant reçu une thérapie systémique de première
ligne (cytokine et sunitinib principalement) [12]. Il est
important de distinguer, parmi les patients ayant
reçu de l’axitinib, les 2 sous-groupes principaux : ceux
prétraités par cytokines (n = 126) avaient une SSP plus
longue que ceux prétraités par sunitinib (n = 184),
avec des médianes de 12,1 mois versus 4,8 mois.
Les résultats d’une seconde étude randomisée de
phase III (AGILE 1052) comparant axitinib et sorafénib
chez des patients en première ou deuxième ligne de
traitement sont attendus.
Quelques données sur les combinaisons
etséquences
La chronicisation ainsi que la multiplicité des possi-
bilités thérapeutiques posent le problème du choix
de l’ordre d’administration des diverses molécules.
En eff et, pour le moment, les études de combinaisons
de thérapies ciblées restent décevantes, à l’image de
l’étude TORAVA (13). Diverses études complémen-
taires de phase II/III randomisées ont été menées,
dont les résultats sont en attente : INTORACT (temsi-
rolimus + bévacizumab versus bévacizumab + IFNα) ;
RECORD-2 (bévacizumab + IFNα versus bévaci-
zumab + évérolimus) ; BEST (4 combinaisons diff é-
rentes comprenant temsirolimus, bévacizumab et
sorafénib). Actuellement, le clinicien propose donc
ces molécules selon 2 modalités principales : soit
2 antiangiogéniques puis 1 inhibiteur de mTOR, soit
une alternance antiangiogénique-inhibiteur de mTOR-
antiangiogénique.
Seules des études rétrospectives, avec de faibles
eff ectifs, ou des études prospectives observationnelles
permettent, pour le moment, d’évaluer l’intérêt de
telle ou telle séquence. Diverses études de phase II/III
sont attendues : PISCES (sunitinib puis pazopanib
ou l’inverse, en tenant compte du choix du patient),
SWITCH (sunitinib puis sorafénib ou l’inverse),
WYETH 404 (temsirolimus versus sorafénib en
deuxième ligne après sunitinib), RECORD-3 (sunitinib
puis évérolimus ou l’inverse). L’étude la plus ambitieuse
est l’essai START, qui comparera 6 stratégies séquen-
tielles diff érentes.
Parmi les nouvelles molécules, le dovitinib est un
ITK de deuxième génération prometteur, ciblant à
la fois les récepteurs au VEGF (Vascular Endothelial
Growth Factor), au PDGF (Platelet-Derived Growth
Factor) mais aussi au FGF (Fibroblast Growth Factor).
L’essai GOLD est une étude de phase IIII randomisée
qui tente de le positionner en troisième ligne chez
des patients ayant reçu 1 seul antiangiogénique et
1 seul inhibiteur de mTOR : cette stratégie originale
favorise une séquence alternant antiangiogénique
et inhibiteur de mTOR.
Conclusion
Les thérapies ciblées ont révolutionné la prise en
charge du cancer du rein métastatique avec, dans
certains cas, une évolution vers une chronicisation
de la maladie. Il est important de ne pas oublier que
seule l’interleukine 2 à haute dose a permis d’obtenir
des rémissions sur le long terme, au prix d’une morbi-
mortalité non négligeable. Le ratio activité/toxicité des
nouvelles biothérapies explique leur succès. Toutefois,
la meilleure séquence de traitement reste à défi nir.
Il y a peu de comparaisons directes de ces molécules
en première ligne, mais de nouvelles données sont
attendues cette année.
L’arrivée de ces molécules innovantes fait aussi évoluer
la prise en charge du cancer du rein métastatique en
fonction de l’histologie du cancer. Ainsi, les doubles
inhibiteurs d’antiangiogéniques et de c-MET (du type
forétinib) semblent intéressants dans le traitement des
carcinomes papillaires (14).
Ces stratégies offrent de nouvelles possibilités
thérapeutiques, et notamment celle de traiter les
patients plus tôt. Trois molécules (sunitinib, sorafénib
et pazopanib) tentent de se positionner dans la prise
en charge adjuvante des cancers du rein localisés
avec des études de phase III randomisées en cours
ou closes aux inclusions : STRAC, SORCE, VEG113387.
En cas de résultats positifs d’une de ces études,
le choix de la première ligne de traitement à la phase
métastatique sera bien entendu conditionné par le
traitement adjuvant reçu par le patient ; ce qui se
fait déjà dans d’autres tumeurs (cancers du sein,
colorectal, etc.). ■
1. Yang JC, Haworth L,
Sherry RM et al. A randomized
trial of bevacizumab, an anti-
vascular endothelial growth
factor antibody, for metastatic
renal cancer. N Engl J Med 2003;
349(5):427-34.
2. Motzer RJ, Hutson TE,
Tomczak P et al. Overall
survival and updated results
for sunitinib compared with
interferon alfa in patients with
metastatic renal cell carci-
noma. J Clin Oncol 2009;27(22):
3584-90.
3. Motzer RJ, Hutson TE,
Olsen MR et al. Randomized
phase II trial of sunitinib on an
intermittent versus continuous
dosing schedule as first-line
therapy for advanced renal cell
carcinoma. J Clin Oncol 2012;
30(12):1371-7.
4. Escudier B, Bellmunt J,
Négrier S et al. Phase III trial
of bevacizumab plus inter-
feron alfa-2a in patients with
metastatic renal cell carci-
noma (AVOREN): fi nal analysis
of overall survival. J Clin Oncol
2010;28(13):2144-50.
5. Rini BI, Halabi S, Rosenberg JE
et al. Phase III trial of beva-
cizumab plus interferon alfa
versus interferon alfa mono-
therapy in patients with meta-
static renal cell carcinoma: fi nal
results of CALGB 90206. J Clin
Oncol 2010;28(13):2137-43.
Références

dossier thématique
Cancer du rein métastatique :
nouvelles molécules,
nouvelles stratégies
Correspondances en Onco-Urologie - Vol. III - no 2 - avril-mai-juin 2012
5353
Cancer du rein métastatique : état des lieux des différentes lignes de traitement
A. Thiery-Vuillemin
6. Melichar B, Bracarda S, Matveev V et al. BEVLiN: Prospective
study of the safety and efficacy of first-line bevacizumab
(BEV) plus low-dose interferon-2a (IFN) in patients (pts) with
metastatic renal cell carcinoma (mRCC). Congrès américain
en cancérologie 2011: abstr. 4546.
7. Sternberg CN, Davis ID, Mardiak J et al. Pazopanib in
locally advanced or metastatic renal cell carcinoma: results
of a randomized phase III trial. J Clin Oncol 2010;28(6):
1061-8.
8. http://www.aveopharma.com/product_candidates/
tivozanib
9. Hudes G, Carducci M, Tomczak P et al.
Temsirolimus, interferon alfa, or both for advanced
renal-cell carcinoma. N Engl J Med 2007;356(22):
2271-81.
10. Escudier B, Eisen T, Stadler WM et al. Sorafenib for
treatment of renal cell carcinoma: fi nal effi cacy and safety
results of the phase III treatment approaches in renal
cancer global evaluation trial. J Clin Oncol 2009;27(20):
3312-8.
11.
Motzer RJ, Escudier B, Oudard S et al.; RECORD-1 Study
Group. Phase 3 trial of everolimus for metastatic renal cell
carcinoma : fi nal results and analysis of prognostic factors.
Cancer 2010;116(18):4256-65.
12.
Rini BI, Escudier B, Tomczak P et al. Comparative eff ec-
tiveness of axitinib versus sorafenib in advanced renal cell
carcinoma (AXIS): a randomised phase 3 trial. Lancet 2011;
378(9807):1931-9.
13. Négrier S, Gravis G, Pérol D et al. Temsirolimus and beva-
cizumab, or sunitinib, or interferon alfa and bevacizumab
for patients with advanced renal cell carcinoma (TORAVA):
a randomised phase 2 trial. Lancet Oncol 2011;12(7):
673-80.
14. Choueiri TK, Vaishampayan UN, Rosenberg JE et al.
A phase II and biomarker study (MET111644) of the dual
Met/VEGFR-2 inhibitor foretinib in patients with sporadic and
hereditary papillary renal cell carcinoma: fi nal effi cacy, safety,
and PD results. Congrès américain en cancérologie GU 2012:
abstr. 355.
Références (suite de la p. 52)
1
/
4
100%