Traitement conservateur des cancers infiltrants (CI) : D

La Lettre du Sénologue - n ° 38 - octobre-novembre-décembre 2007
Dossier
Dossier
16
Traitement conservateur des cancers infiltrants (CI) :
influence de la présence de CLIS associé
The impact of lobular carcinoma in situ (LCIS) in association
with invasive breast cancer in breast-conserving therapy
IP B. Cutuli*
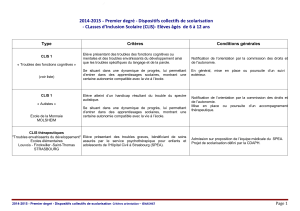
Parmi les facteurs anatomopathologiques favorisant la
récidive locale (RL) après traitement radiochirurgical
conservateur d’un cancer infiltrant (CI), l’état des berges
d’exérèse et la présence d’une composante intracanalaire (plus
ou moins étendue) ont été largement décrits (1, 2). En revanche,
peu de données sont disponibles concernant l’influence d’une
composante de carcinome lobulaire in situ (CLIS).
Trois études déjà anciennes ont fourni des résultats contra-
dictoires (3-5). Moran, en 1998 (3), a rapporté l’expérience de
l’université de Yale. Parmi 1 096 patientes traitées avant 1992 par
association radiochirurgicale pour un CI, 51 (4,6 %) présentaient
une composante de CLIS associée. Les taux de récidive locale
(RL) à 10 ans étaient de 23 % et 17 % avec et sans CLIS associé
(p = NS). Les auteurs concluaient donc que le traitement conser-
vateur restait faisable dans cette situation. Toutefois, dans cette
étude, l’analyse des marges d’exérèse n’était pas rigoureuse, et le
nombre de “réexcisions” très différent entre les deux groupes.
L’expérience des équipes de Boston a été ensuite rapportée par
Abner en 2000 (4). Parmi 1 181 patientes traitées de 1968 à
1986, 137 (12 %) avaient une composante de CLIS. Les taux
de RL à 8 ans étaient identiques (12 %) pour les deux groupes.
Dans cette étude également, on notait d’importantes insuffi-
sances en ce qui concerne l’évaluation des marges et la “quan-
tification” de l’étendue du CLIS.
La troisième étude du groupe de Philadelphie a été rapportée
par Sasson en 2001 (5). Parmi 1 274 patientes traitées entre
1979 et 1995, 65 (5 %) avaient une composante de CLIS. Cet-
te fois, on retrouve une différence très significative entre les
deux groupes avec des taux de RL à 10 ans de 6 % versus 29 %
(p = 0,0003) en cas d’absence ou présence de CLIS associé.
Toutefois, pour les patientes avec CLIS ayant reçu du tamoxi-
fène, ce taux chutait à 8 %. En revanche, le risque de RL était
augmenté en cas d’antécédents familiaux de cancer du sein et
chez les femmes de moins de 50 ans.
Deux autres études, publiées en 2006, donnent également des
résultats contradictoires. Ben David (6), à partir d’une série de
1 196 patientes traitées entre 1989 et 2003, a comparé les 64 pa-
tientes (5 %) avec une composante de CLIS associée à 121 autres
sans CLIS (cas “contrôles”). Une revue centralisée des lames a été
réalisée pour les patientes avec une composante de CLIS, per-
mettant d’en préciser la taille, l’uni- ou la multifocalité et l’étendue
de la marge. Avec un recul de 4 ans, les taux de RL dans les deux
groupes sont identiques (1,7 %) et les auteurs concluent donc que
*Service de radiothérapie-oncologie, polyclinique de Courlancy, Reims.
la présence de CLIS n’est pas un facteur de risque de RL. La der-
nière étude rapportée par Jolly (7) a analysé 607 patientes traitées
de 1980 à 1986 au William Beaumont Hospital ; 56 (9 %) avaient
une composante de CLIS associée. Les taux actuariels de rechute
à 10 ans sont de 7 % et 14 % dans les deux groupes sans et avec
CLIS (p = 0,04 %). Cependant, à 15 ans, les taux sont superposa-
bles (15 %) pour les deux populations.
Les auteurs considèrent que la présence de CLIS est un facteur
de risque de RL indépendant et suggèrent la nécessité d’une
exérèse “complète” de ces lésions.
En conclusion, les résultats sont contradictoires, car les compa-
raisons inter-études sont très difficiles, et les analyses anatomopa-
thologiques ne tiennent pas compte du type de CLIS. Il n’est pas
envisageable de proposer une reprise systématique des berges en
cas d’atteinte par du CLIS, mais il est possible que les formes plus
agressives (LIN 3), en particulier chez les femmes jeunes, doivent
faire l’objet d’une résection complète et on peut se demander s’il
ne serait pas nécessaire de rediscuter des “marges d’exérèses sai-
nes” minimales pour ces patientes, afin de réduire le risque de RL.
D’autres études, tant rétrospectives que prospectives, semblent
indispensables afin de répondre plus précisément à cette ques-
tion. n
RéféRences bibliogRaphiques
1. Mauriac L, Luporsi E, Cutuli B et al. SOR : Cancers du sein non mé-
tastatiques. John Libbey, Montrouge 2001.
2. Horst KC, Smitt MC, Goffinet DR et al. Predictors of local recurrence
after breast conservation therapy. Clin Breast Cancer 2005;5:425-38.
3. Moran M, Haffty BG. Lobular carcinoma I situ as a component of
breast cancer: the long-term outcome in patients treated with breast-
conservation therapy. Int J Radiat Oncol Biol Phys 1998;40:353-8.
4. Abner AL, Connolly JL, Recht A et al. e relation between the pre-
sence and extent of lobular carcinoma in situ and the risk of local recur-
rence for patients with infiltrating carcinoma of the breast treated with
conservative surgery and radiation therapy. Cancer 2000;88:1072-7.
5. Sasson AR, Fowble B, Hanlon AL et al. Lobular carcinoma in situ
increases the risk of local recurrence in selected patients with stages I
and II breast carcinoma treated with conservative surgery and radia-
tion. Cancer 2001;91:1862-9.
6. Ben David MA, Kleer CG, Paramagul C, Griffith KA, Pierce LH. Is
lobular carcinoma in situ as a component of breast carcinoma a risk fac-
tor for local failure after breast-conserving therapy? Results of a matched
pair analysis. Cancer 2006;106:28-34.
7. Jolly S, Kestin LL, Goldstein NS, Vicini FA. e impact of lobular car-
cinoma in situ in association with invasive breast cancer on the rate of
local recurrence in patients with early-stage breast cancer treated with
breast-conserving therapy. Int J Radiat Oncol Biol Phys 2006;66:365-71.
1
/
1
100%