Rhumatologie pédiatrique R Juvenile arthritis

Rhumatologie pédiatrique
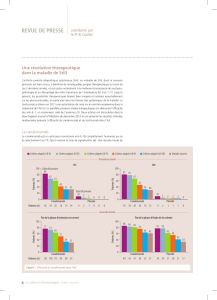
Figure 1.
Pourcentage de patients sans poussée pendant la
phase en double aveugle chez les enfants atteints d’AJI poly-
articulaire et traités par adalimumab ou placebo avec ou sans
méthotrexate.
80
Pourcentage de patients
sans poussée
60
40
20
0 MTX Sans MTX
p = 0,015
Placebo Adalimumab
p = 0,031
65
37
71
43
La Lettre du Rhumatologue - n° 328 - janvier 2007
39
Rhumatologie pédiatrique
Rhumatologie pédiatrique
Juvenile arthritis
IP J. Morel
POINTS FORTS
L’adalimumab seul ou en association avec le méthotrexate
est un traitement ecace dans la forme polyarticulaire de
l’arthrite juvénile idiopathique (AJI). L’association avec le
méthotrexate ne donne pas plus d’infections sévères que
la monothérapie.
L’abatacept permet d’obtenir une amélioration clinique,
avec une bonne tolérance dans les formes oligo- et poly-
articulaires de l’AJI.
Le tocilizumab a démontré une ecacité sur les symptômes
articulaires et la èvre dans la forme systémique de l’AJI.
L’ADALIMUMAB DANS LES ARTHRITES JUVÉNILES
IDIOPATHIQUES POLYARTICULAIRES
Une étude randomisée multicentrique de phase III, en aveugle
contre placebo, a permis d’évaluer l’efficacité de l’adalimumab
dans l’arthrite juvénile idiopathique (AJI). Pour des raisons éthi-
ques, le design de l’étude chez l’enfant comprend trois phases :
une phase ouverte pendant laquelle tous les enfants reçoivent
le traitement, puis une phase en double aveugle avec un rando-
misation en deux groupes, l’un recevant le traitement et l’autre
le placebo. Après cette période ou en cas de poussée, tous les
enfants passent dans la troisième phase, qui est ouverte, et reçoi-
vent le traitement. Dans cette étude, la synergie et la tolérance
de l’association au méthotrexate (MTX) ont été étudiées. Un
groupe recevait du MTX et pas l’autre. Cent soixante-dix enfants
(84 dans le groupe avec MTX et 86 dans le groupe sans MTX),
âgés de 4 à 17 ans et atteints d’une arthrite polyarticulaire active
(plus de 5 articulations gonflées et plus de 3 douloureuses), ont
d’abord été inclus dans la phase ouverte de 16 semaines, puis
133 l’ont été dans l’étude randomisée comparant l’efficacité de
l’adalimumab (24 mg/m², maximum : 40 mg/dose), associé ou
non au MTX. Le critère principal d’évaluation était la poussée,
définie par :
– l’absence d’amélioration d’au moins 30 % de 3 des 6 critères
de l’ACR pédiatriques,
– l’amélioration de 30 % pour un seul de ces 6 critères,
– ou l’existence de plus de 2 articulations gonflées avec une
amélioration de l’activité globale de la maladie mesurée sur
l’EVA inférieure à 30 %.
Le pourcentage de patients sans poussée est significative-
ment plus important dans les groupes traités par adalimumab
(figure 1). L’association au MTX n’augmente pas l’efficacité
clinique de l’adalimumab, avec un pourcentage de répondeurs
même plus important dans le groupe adalimumab en monothé-
rapie. Globalement, l’adalimumab a été bien toléré. La plupart
des effets indésirables signalés ont été des infections respiratoires
hautes. Aucune infection opportuniste ou tuberculeuse n’a été
rapportée. Il n’y avait pas de différences statistiquement significa-
tives en termes d’effets indésirables entre les différents groupes.
Cependant, on dénombre plus d’effets indésirables graves avec le
traitement par adalimumab. Il n’y a pas plus d’infections graves
lorsque l’adalimumab est associé au MTX.
L’ABATACEPT DANS LES AJI OLIGO
ET POLYARTICULAIRES
L’abatacept est un modulateur des molécules de costimula-
tion qui a fait l’objet d’une étude dans l’AJI, d’abord en ouvert
pendant 113 jours (période A), puis randomisée en double
aveugle pendant 6 mois (période B) suivie d’une extension
en ouvert (période C). Cent quatre-vingt-dix enfants âgés de
12,4 ans et ayant une AJI active de forme polyarticulaire ont
LR-NN328ACR-0107.indd 39 29/01/07 10:27:07

Rhumatologie pédiatrique
Figure 3.
Pourcentage de patients répondeurs ACR 30, 50 et 70
pendant la phase en double aveugle chez les enfants atteints
d’AJI systémique et traités par tocilizumab ou placebo.
80
Pourcentage de patients répondeurs ACR (N)
60
40
20
0 ACR 30 ACR 50 ACR 70
Tocilizumab (n = 20) Placebo (n = 23)
100 90,0
60,9
90,0
56,5
85,0
34,8
Figure 2.
Pourcentage de patients sans poussée pendant la phase
en double aveugle chez les enfants atteints d’AJI oligo- et poly-
articulaire et traités par abatacept ou placebo.
1
Proportion de patients sans poussée
0,8
0,6
0,4
0
Abatacept Placebo
0 1 2 3 4 5 6
Mois
* Log Rank Test
0,2 p = 0,0002*
La Lettre du Rhumatologue - n° 328 - janvier 2007
40
Rhumatologie pédiatrique
été traités, dans cette étude, par l’abatacept seul (10 mg/kg en
perfusion d’une heure) à J1, J15 et J29, puis tous les 28 jours
(jusqu’à 113 jours) par l’abatacept associé au MTX. Dans
l’étude initiale ouverte, l’état de 64,7 %, 49,5 % et 28,3 % des
enfants était amélioré en critères AJI 30/50/70. Cent vingt-
deux enfants répondeurs ACR 30 ont été randomisés dans la
phase en double aveugle. Ils étaient âgés en moyenne de 12,3
(± 3) ans, avec une durée de la maladie de 3,9 (± 3,6) ans, et
77 % recevaient un traitement par MTX. Au cours de l’étude
randomisée, qui fait suite à l’étude ouverte initiale, la propor-
tion de patients sans poussée était supérieure dans le groupe
abatacept comparativement au groupe placebo (figure 2).
La tolérance a été identique dans les deux groupes lors de
l’étude randomisée, mais, dans la phase ouverte, 5 événements
indésirables graves (dont une leucémie lymphoïde et une vari-
celle) ont été rapportés. L’abatacept est donc un traitement
prometteur des formes polyarticulaires d’AJI, mais il faudra
préciser sa tolérance chez l’enfant.
LE TOCILIZUMAB DANS LES AJI SYSTÉMIQUES
Une étude de phase III randomisée, en double aveugle, contre
placebo a étudié l’efficacité du tocilizumab (Actemra®) [8 mg/kg/
2 semaines], un anticorps monoclonal antirécepteur de l’IL-6.
Cinquante-six enfants âgés en moyenne de 8,3 ans ont été inclus.
Le tocilizumab a permis, dans une première partie ouverte de
l’étude, une amélioration rapide des patients : disparition de la
fièvre, normalisation de la CRP (en 2 semaines). Au terme des
6 semaines de l’étude ouverte, l’amélioration des critères ACR
pédiatrique 30, 50, 70 était respectivement de 91,1 %, 85,7 % et
67,9 %. Dans une deuxième partie contrôlée (versus placebo)
[n = 43], l’amélioration est statistiquement significative en faveur
du tocilizumab versus le placebo. À la fin de la période en double
aveugle, les critères ACR 30, 50, 70 étaient respectivement de
90 %, 90 % et 85 % dans le groupe traité par tocilizumab contre
60,9 %, 56,5 % et 34,8 % dans le groupe placebo (figure 3). Les
principaux effets indésirables ont été la fièvre, les infections
ORL, les hépatites, les leucopénies et une augmentation tran-
sitoire du cholestérol total. Deux effets indésirables graves ont
été rapportés, avec un choc anaphylactique et une hémorragie
digestive. L’étude d’extension concernant la tolérance est toujours
en cours.
LR-NN328ACR-0107.indd 40 29/01/07 10:27:09
1
/
2
100%