Prise en charge médico-chirurgicale M

L
e traumatisme crânien est une agression cérébrale par
une force externe qui provoque une altération de l’état
de conscience. Grave lorsqu’il s’accompagne d’un score
de Glasgow (Glasgow coma score [GCS]) inférieur ou égal à 8,
il constitue un challenge médical en raison de son pronostic
sévère et du bouleversement personnel, familial et professionnel
qu’il entraîne.
La richesse de la littérature disponible contraste avec la pénurie
d’essais thérapeutiques randomisés contrôlés. Rares sont les
recommandations de haut grade qui figurent dans les guidelines
françaises publiées en 1998 par l’Agence nationale d’accréditation
MISE AU POINT
La Lettre du Neurologue - vol. X - n°2 - février 2006 55
* Département d’anesthésie réanimation, hôpital Beaujon, Clichy.
Prise en charge médico-chirurgicale
des traumatisés crâniens graves à la phase aiguë
Early management of traumatic brain injury
● P. Trouiller*, J. Mantz*
■
Le traumatisme crânien grave est défini par un score de
Glasgow ≤8.
■
L’ischémie, les altérations membranaires, la réaction inflam-
matoire et l’œdème cérébral entraînent une aggravation
secondaire des lésions.
■
La réanimation préhospitalière (intubation, ventilation,
support hémodynamique) conditionne le pronostic.
■
La prise en charge d’un choc hémorragique dans le cadre
d’un polytraumatisme doit rester une priorité.
■
Il existe des indications neurochirurgicales urgentes à la
phase précoce.
■
Le monitoring de la pression intracrânienne est recommandé
en cas de traumatisme crânien grave.
■
La neuroréanimation a pour but de lutter contre les agres-
sions cérébrales secondaires d’origine systémique.
■
L’optimisation du rapport besoins en O2/débit sanguin
cérébral nécessite la diminution de la pression intracrâ-
nienne, l’augmentation de la pression de perfusion cérébrale
et la baisse de la consommation cérébrale en O2.
■
Le traitement de l’hypertension intracrânienne post-trauma-
tique réfractaire comprend l’osmothérapie et les barbituriques.
■
Le rapport bénéfice/risque de l’hypothermie et de la crâniec-
tomie décompressive doit être précisé par des études pros-
pectives.
Mots-clés : Hypertension intracrânienne traumatique –
Neuroréanimation.
POINTS FORTS
POINTS FORTS
Severe brain injury occurs often in a context of multiple
trauma. Any injury causing haemorrhage must be adressed
first before the need for any neurosurgical intervention.
Thereafter, specific neurologic critical care must be underta-
ken. By decreasing intracranial pressure, increasing cerebral
perfusion pressure and optimisation of oxygen consumption
to cerebral blood flow, neurologic critical care aims to
decrease secondary insults caused by cellular ischemia,
inflammatory cascade and brain swelling. Systemic factors
of secondary cerebral damage have to be carefully conside-
red. After basic rules of critical care like ventilation, fluid
resuscitation, cardiovascular support and seizure prophylaxis,
cerebrospinal fluid drainage, barbiturates and osmotherapy
with mannitol or hypertonic saline can be used in case of
refractory intracranial hypertension. Hyperventilation can
induce ischemic damages; mild hypothermia and decom-
pressive craniectomy failed to improve neurological outcome.
An aggressive approach to brain injury management focusing
on control of intracranial pressure may improve outcome.
However several clinical prospective studies must be carried
out to specify the usefulness of neurological care strategies.
Keywords: Traumatic intracranial hypertension – Neuro-
logical critical care.
SUMMARY
SUMMARY

MISE AU POINT
La Lettre du Neurologue - vol. X - n°2 - février 2006
56
et d’évaluation en santé (1) et celles publiées en 2000 par la Brain
Trauma Foundation (2), regroupement de sociétés savantes de
neurotraumatologie nord-américaines.
Après un rappel des particularités épidémiologiques, nous aborde-
rons la physiopathologie puis les principes de la prise en charge,
multidisciplinaire. Nous envisagerons les nouvelles pistes théra-
peutiques qui nous permettront, peut-être, de diminuer l’importance
des séquelles post-traumatiques.
ÉPIDÉMIOLOGIE ET MÉCANISMES LÉSIONNELS
Les traumatismes crâniens (TC) graves représentent la première
cause de mortalité chez l’enfant et l’adulte jeune et sont respon-
sables d’environ 40 % des décès chez les 15-25 ans. Leur incidence
en France est estimée à environ 155 000 nouveaux patients par
an (3), avec une prédominance masculine (70 %). Les étiologies
sont dominées par les accidents de la voie publique (50 à 60 % ;
accidents mettant en cause des véhicules légers [60 à 80 %], des
deux-roues [10 à 20 %], des piétons [15 %]), les chutes acciden-
telles ou volontaires (20 à 30 %) et les accidents de sports loisirs
(10 à 20 %) (3). Les facteurs de risque reconnus sont les troubles
du comportement (prise d’alcool, conduites à risque) et un milieu
social défavorisé. Cependant, en raison de la diminution des acci-
dents graves secondaires à la mise en place d’une politique de
sécurité routière, nous constatons une augmentation relative des
accidents domestiques survenant chez les sujets âgés. La mortalité
globale est estimée entre 25 % et 35 %, soit 20 à 30 décès annuels
pour 100 000 habitants en France ; 60 à 70 % des décès ont lieu
dans les 24 premières heures.
Le coût estimé de la prise en charge initiale est de 60 000 euros
par patient (3).
Dans 75 % cas, il existe d’autres lésions associées faisant du
patient un polytraumatisé.
PHYSIOPATHOLOGIE
Les lésions
Les lésions peuvent être extracérébrales (hématome extradural
[HED], hématome sous-dural aigu [HSD], hémorragie méningée
[HM]) ou intracérébrales. La contusion s’observe là où le paren-
chyme a été violemment projeté contre l’os (lésion de coup-
contrecoup). Elle est un foyer de déchirure parenchymateuse,
avec des pétéchies hémorragiques visibles sous forme d’hyper-
densités spontanées diffuses, associées ou non à l’hyperdensité
d’un hématome intracérébral et/ou à l’hypodensité d’un œdème.
Les lésions axonales diffuses (LAD) résultent d’un étirement
des fibres nerveuses responsable de lésions multiples et graves
affectant l’ensemble de l’encéphale. Le scanner cérébral est
souvent normal. Elles doivent être différenciées des lésions du
tronc cérébral, auparavant incriminées à l’excès, et qui peuvent
avoir une symptomatologie proche. L’IRM a une meilleure
spécificité pour le diagnostic de ces deux types de lésions. Enfin,
la plaie crâniocérébrale et les embarrures peuvent également
coexister.
À l’échelon cellulaire, quatre phénomènes clés interviennent (4) :
– l’ischémie, provoquée par la perte de vasodilatateurs endo-
gènes comme le monoxyde d’azote (NO) et la présence de vaso-
constricteurs comme l’endothéline 1, est responsable d’une chute
locale de la pO2du pH et de l’ATP, et d’une augmentation de la
pCO2(5) ;
– il va s’ensuivre une accumulation de glutamate (5) [acide aminé
excitateur agoniste du récepteur NMDA] entraînant une altéra-
tion de l’homéostasie calcique (augmentation du Ca++ intracel-
lulaire) et une activation d’enzymes Ca dépendantes (protéases,
endonucléases) responsables de la formation de radicaux libres
et d’altérations membranaires conduisant à la mort neuronale ;
– ces lésions de stress oxydatif s’associent aux lésions endothé-
liales secondaires à la libération de cytokines pro-inflamma-
toires ;
– la conjonction de ces mécanismes explique l’association d’un
œdème cérébral cellulaire et vasogénique lorsque les lésions de
la barrière hémato-encéphalique sont constituées (6).
Retentissement sur l’hémodynamique intracérébrale
L’encéphale est un organe fragile (2 % de la masse corporelle)
consommant 15 % du débit cardiaque (soit 50-55 ml/mn/100 g)
et 20 % de la consommation totale en O2. Le principal substrat
est le glucose ; les stocks de glycogène sont très faibles et il
n’existe pas de possibilité de métabolisme cellulaire en anaéro-
bie. On appelle pression de perfusion cérébrale (PPC) la diffé-
rence entre la pression artérielle moyenne (PAM) et la pression
intracrânienne (PIC) [PPC = PAM – PIC].
La circulation cérébrale est dotée d’une autorégulation, c’est-
à-dire d’un maintien du débit sanguin cérébral (DSC) à un niveau
constant lors de variations de PPC au sein d’un intervalle appelé
plateau d’autorégulation. Cette autorégulation se fait par des
modifications du diamètre des artères corticales et pie-mériennes.
Elle est dépendante du tonus myogénique, du métabolisme et de
la demande en O2, du tonus sympathique et de la fonction endo-
théliale. Toute augmentation de la pCO2tissulaire, toute acidose
ou hypoxie tissulaire, toute hypotension artérielle entraîne ainsi
une vasodilatation afin de maintenir constant le DSC. En deçà du
point d’inflexion inférieur (capacités de vasodilatation dépas-
sées), le DSC diminue passivement avec la chute de pression
artérielle, exposant ainsi à l’ischémie cérébrale. Au-delà du point
d’inflexion supérieur (capacités de vasoconstriction dépassées),
toute augmentation de pression artérielle entraîne une élévation
parallèle du DSC (cas des encéphalopathies hypertensives), avec
les risques associés de lésions de la barrière hémato-encéphalique
et d’œdème. Environ 60 % des patients perdent leur autorégula-
tion cérébrale au décours d’un TC, ce qui rendra plus difficile la
gestion de l’hémodynamique intracérébrale.
L’effet de masse post-traumatique peut s’accompagner d’une
hypertension intracrânienne (HTIC) définie par une PIC supé-
rieure à 15 mmHg. L’HTIC entraîne une compression des
microvaisseaux et une baisse de la PPC, et expose aux risques

La Lettre du Neurologue - vol. X - n°2 - février 2006 57
d’ischémie et d’engagement. L’ischémie entraîne à son tour une
majoration de l’œdème, et donc une augmentation de l’effet de
masse, une élévation supplémentaire de la PIC, une nouvelle
diminution de la PPC, et donc une aggravation de l’ischémie.
Cette boucle rend compte de l’autoaggravation des lésions.
Cela peut encore être amplifié par des facteurs systémiques
comme l’hypotension artérielle (hypovolémie sur saignement
extracrânien), l’anémie, l’hypoxémie, l’hypercapnie ou l’hyper-
thermie, qui vont entraîner une vasodilatation réflexe, une majo-
ration du volume sanguin cérébral et de la PIC, et donc d’une
baisse de la PPC responsable d’une aggravation de l’ischémie.
Une hyponatrémie, une hyper- ou hypoglycémie aggravent éga-
lement les lésions. Cette cascade, décrite par Rosner (7), est à
l’origine de la notion d’ACSOS (agression cérébrale secondaire
d’origine systémique). La neuroréanimation repose sur des
manœuvres visant à abaisser la PIC, rétablir la PPC et contrôler
les ACSOS (1, 6, 7). Elle doit être entreprise dès la phase pré-
hospitalière (1).
PRISE EN CHARGE PRÉHOSPITALIÈRE
La mortalité accrue des traumatisés crâniens graves souffrant
d’hypotension artérielle et/ou d’hypoxémie a été démontrée par les
travaux de Chesnut (8). L’intubation orotrachéale est fortement
recommandée afin de protéger les voies aériennes, d’assurer une
oxygénation (saturation en O2> 96 %) et d’éviter une hypercapnie.
Le remplissage vasculaire (solutés macromoléculaires ou sérum
salé isotonique) puis les catécholamines sont la base de la réani-
mation circulatoire, dont l’objectif est de maintenir une PAM à
70-80 mmHg (1, 2, 8). En cas de signes cliniques évoquant d’emblée
un engagement cérébral, une osmothérapie par mannitol ou
sérum salé hypertonique (SSH) et une hyperventilation (cf. infra)
sont recommandées (6).
Outre l’initialisation de la réanimation, l’équipe médicale mobile
et le médecin régulateur décideront du transport du patient vers
un service de neurochirurgie ou un centre de polytraumatologie
possédant un plateau technique polyvalent (chirurgie générale,
imagerie, neurochirurgie, radiologie interventionnelle, réanima-
tion) pouvant offrir une prise en charge multidisciplinaire.
PRISE EN CHARGE HOSPITALIÈRE
Investigation et monitoring
En dehors des examens biologiques habituels, le scanner céré-
bral est le premier examen à réaliser. Il permet d’évaluer les
lésions, leur caractère chirurgical ou non et leur retentissement
(engagement sous-falcoriel, temporal, diencéphalique central ou
cérébelleux), et de détecter la présence d’un œdème cérébral. Si
l’examen est réalisé dans les trois premières heures, un contrôle
dans les 24 heures doit être effectué (lésions potentiellement
retardées). La réalisation de coupes du rachis cervical avec
reconstructions doit être systématique. Un angioscanner cérébral
est indiqué en cas de suspicion de dissection artérielle trauma-
tique (traumatisme par décélération). Le moindre doute sur
l’existence de lésions extracrâniennes associées doit conduire à
la réalisation d’un body scanner, examen radiologique de réfé-
rence chez les polytraumatisés.
Bien que le bénéfice sur la survie ne soit pas formellement éta-
bli, la mise en place d’un monitorage de la PIC est indiquée par
la plupart des experts (1, 2) en cas de :
– GCS ≤8 et scanner anormal ;
– GCS ≤8 et scanner normal si présence d’au moins deux critères
parmi les suivants : âge ≥40 ans, hypotension, déficit moteur,
lésions traumatiques empêchant le réveil.
Dans les autres cas, l’indication est à discuter. L’association à un
cathéter artériel est indispensable. La ventriculostomie est la
technique de référence pour mesurer la PIC. Elle permet ainsi un
drainage de liquide céphalorachidien (LCR) en cas d’HTIC. Les
cathéters intraparenchymateux sont une alternative, surtout si les
ventricules sont collabés ; ils exposent au risque de dérive du
zéro, et la fiabilité de la mesure est donc discutable. Il n’y a plus
d’indication aux cathéters sous- ou extraduraux. Différentes
équipes ont montré que la présence d’un neurochirurgien n’était
pas indispensable pour la mise en place d’un capteur de PIC intra-
parenchymateux. Cependant, à ce jour, il semble raisonnable de
confier les victimes de TC grave avec HTIC aux centres disposant
d’une équipe médicochirurgicale de neurotraumatologie.
Le Doppler transcrânien est une technique non invasive permet-
tant l’évaluation du DSC par la mesure des vélocités de l’artère
sylvienne. L’étude des variations du DSC permet de suivre l’effi-
cacité thérapeutique. Son apprentissage rapide et sa reproducti-
bilité en font un outil appréciable.
L’électroencéphalogramme (EEG) doit être effectué régulière-
ment, à la recherche d’activité comitiale. Son intérêt pronostique
est médiocre.
La saturation veineuse jugulaire en O2(SvjO2) (6) peut être
monitorée par cathétérisme de la veine jugulaire interne. Elle
reflète l’adéquation du DSC à la consommation cérébrale en O2
et ses variations sous traitement permettent l’étude des variations
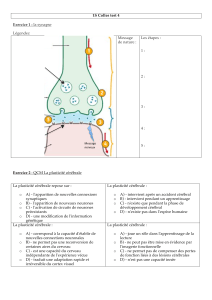
Figure. Autorégulation cérébrale. DSC : débit sanguin cérébral ; PPC :
pression de perfusion cérébrale ; RVC : résistances vasculaires cérébrales ;
cercles : calibre des vaisseaux.
DSC
ml/mn/100g
50 150 PPC
DSC = PPC/RVC

MISE AU POINT
La Lettre du Neurologue - vol. X - n°2 - février 2006
58
du DSC. Son caractère invasif et l’absence de bénéfices prouvés
sur le pronostic font proposer cette technique aux patients atteints
d’HTIC réfractaire.
La microdialyse permet l’analyse de métabolites cellulaires
(lactates) reflétant l’ischémie. L’IRM fonctionnelle et la tomo-
graphie par émission de positrons sont des techniques expéri-
mentales.
Principes thérapeutiques
Le traumatisé crânien grave est fréquemment un patient poly-
traumatisé. En présence d’un choc hémorragique, un geste d’hé-
mostase (chirurgical ou radiologique interventionnel) doit rester
une priorité absolue.
Il faut ensuite reconnaître les indications neurochirurgicales
formelles et urgentes que sont l’HED symptomatique, l’HSD de
plus de 5 mm ou associé à une déviation de la ligne médiane de
plus de 5 mm, l’hydrocéphalie aiguë et l’embarrure ouverte (1).
Une embarrure fermée compressive ou un hématome intracéré-
bral (ou contusion) de plus de 15 ml [recommandations fran-
çaises (1)] ou de plus de 25 ml [recommandations américaines
(2)] sont également des indications neurochirurgicales, d’autant
qu’il existe une déviation de la ligne médiane de plus de 5 mm et
une oblitération des citernes de la base.
L’indication neurochirurgicale étant éliminée, la conduite d’une
neuroréanimation spécialisée est recommandée afin de prévenir
au maximum l’aggravation secondaire des lésions (pronostic vital
engagé à quelques heures en cas de poussée œdémateuse ou
ischémique). Les principes en sont :
– la réduction du volume intracérébral (évacuation de l’héma-
tome, dérivation de LCR, osmothérapie) pour diminuer la PIC
(objectif : < 20-25 mmHg) ;
– le maintien d’une hémodynamique systémique (maintien de la
PAM et de la PPC, objectif : > 65-70 mmHg) ;
– la réduction de la consommation cérébrale en O2à son mini-
mum (sédation, antiépileptique, hypothermie) afin de maintenir
l’adéquation des besoins en O2par rapport au DSC ;
– le contrôle des ACSOS (tableau).
Différents traitements sont à notre disposition (1, 2). Pris indivi-
duellement, aucun n’a fait la preuve formelle de son efficacité par
un essai de puissance méthodologique satisfaisante. Cependant,
de nombreuses études de cohorte sont en faveur d’une améliora-
tion du pronostic lorsqu’une procédure standardisée de neuro-
réanimation est mise en place.
Moyens thérapeutiques
La sédation (1), par la narcose et l’analgésie, diminue la consom-
mation cérébrale en O2et permet l’adaptation du patient à son
ventilateur. L’hypercapnie étant délétère, une pCO2de 35 mmHg
est habituellement recherchée. La durée de sédation nécessaire
fluctue entre 2 et 7 jours selon l’évolution de l’HTIC. Il semble
raisonnable d’obtenir 48 heures de PIC stable et inférieure à
20 mmHg avant de commencer une phase de réveil.
L’hyperthermie (> 38 °C) est délétère par effet vasodilatateur
(augmentation de la PIC) et par augmentation du métabolisme.
Les antipyrétiques doivent être largement utilisés.
En l’absence de lésions rachidiennes instables, la surélévation de
la tête (proclive de 30°) optimise le retour veineux jugulaire et
contribue à la diminution du volume sanguin cérébral. En phase
d’HTIC, l’hémodynamique systémique doit être adaptée afin
de maintenir une PPC satisfaisante en augmentant la PAM [rem-
plissage, catécholamines de type noradrénaline] (2, 6). L’hémo-
globinémie doit être maintenue à au moins 9 g/dl afin d’optimi-
ser le transport artériel en O2.
La PIC peut être abaissée par soustraction de LCR lorsqu’un
cathéter de ventriculostomie est présent (1).
L’utilisation d’anticonvulsivants en prévention de l’épilepsie
précoce est recommandée pendant 7 jours pour tous les TC
graves (1). Le choix de la molécule est fonction des habitudes de
chacun. Il n’existe pas à ce jour d’indication à une prévention
systématique des crises tardives, sauf après intervention neuro-
chirurgicale ou embarrure.
Le contrôle glycémique doit être strict, en évitant les apports
glucosés hypotoniques dans les 24 premières heures et en utili-
sant secondairement de l’insuline durant la nutrition entérale,
l’hyperglycémie pouvant aggraver les lésions. Les anomalies de
l’hémostase doivent être corrigées afin de limiter le saignement
intracrânien.
Les traitements complémentaires et spécifiques suivants sont pro-
posés lorsque, à ce stade, l’HTIC persiste.
Le mannitol (9), glucide non métabolisé, est utilisé pour ses
propriétés osmotiques mais surtout rhéologiques. Son admi-
nistration (0,5-1 g/kg en 20 minutes) améliore la PPC (par
augmentation de la PAM : effet volume), mais aussi la micro-
circulation en abaissant la viscosité plasmatique (par hémo-
dilution) et en optimisant la déformabilité des érythrocytes.
L’effet de déshydratation intracellulaire par hyperosmolarité
n’est que secondaire et permet la prolongation de l’effet (entre
1 et 8 heures). Son utilisation est donc préconisée, d’autant que
la barrière hémato-encéphalique est intacte, ce qui est difficile à
évaluer en pratique clinique. L’osmolarité plasmatique ne doit
cependant pas dépasser 320 mOsm/l. Une alternative proposée
est l’utilisation du sérum salé hypertonique (4) [SSH : NaCl
7,5 % 250 ml], qui possède des effets équivalents ou supérieurs
à ceux du mannitol. Il permet une diminution du contenu céré-
bral en eau si la barrière hémato-encéphalique est intacte et
améliore la microcirculation cérébrale. Son intérêt se manifeste
surtout à la phase initiale et en cas de choc hémorragique associé
au TC, en raison de ses effets bénéfiques sur la circulation systé-
mique.
ACSOS
PPC > 65-70 mmHg Normothermie
Hb=9-10g/dl Normoglycémie
SpO2> 95 %, PaO2>90mmHg Natrémie : 140-145 mmol/l
pCO2=35-38mmHg
Tableau. ACSOS: agression cérébrale secondaire d’origine systémique.

La Lettre du Neurologue - vol. X - n°2 - février 2006 59
Le Pentothal®(2) [dose de charge de 5-10 mg/kg, puis perfusion
continue de 3-5 mg/kg/h], bien que responsable d’une baisse du
DSC par vasoconstriction cérébrale et par diminution du débit
sanguin systémique (effets inotropes négatifs et hypotenseurs),
permet d’abaisser la PIC en diminuant la consommation céré-
brale en O2: les barbituriques permettent ainsi d’optimiser le
couplage DSC/consommation en O2. Quatre-vingt-cinq pour cent
des patients sont répondeurs. Les posologies sont adaptées pour
obtenir des burst suppressions à l’EEG. Un monitoring du DSC
par SvjO2ou Doppler transcrânien est alors indiqué afin de dépis-
ter une ischémie cérébrale secondaire. Les effets indésirables
autres sont une dégradation de l’hémodynamique systémique,
une majoration du risque de pneumopathie sous ventilation méca-
nique (par effet immunosuppresseur), l’hypothermie, une dys-
fonction hépatique ou rénale, une hypokaliémie. Les barbituriques
ne sont pas indiqués en prophylaxie de l’HTIC (1).
L’hyperventilation, par effet vasoconstricteur cérébral, diminue
le volume sanguin cérébral et donc la PIC, mais sans diminuer la
consommation cérébrale en O2(risque d’ischémie). Son effica-
cité n’est pas prouvée dans l’HTIC réfractaire. Elle n’est donc
pas recommandée en dehors de la présence de signes d’engage-
ment dès la phase préhospitalière (6) [utilisation transitoire]. En
cas d’HTIC réfractaire associée à un hyperdébit sanguin cérébral,
l’hypercapnie est proposée par certains auteurs sous réserve d’un
monitoring par SvjO2ou Doppler transcrânien. La contre-indi-
cation est formelle en cas de SvjO2inférieure à 50 %.
L’hypothermie (33 °C) a été testée dans le but de réduire le
métabolisme cérébral et le volume sanguin cérébral (4, 6). Des
effets immunomodulateurs anti-inflammatoires lui sont attribués.
Une méta-analyse récente a regroupé 748 patients de 8 études
randomisées contrôlées aux résultats contradictoires et a conclu à
l’absence de bénéfice de l’hypothermie (10). Elle reste néanmoins
utilisable en cas d’HTIC rebelle, associée à une curarisation afin
de supprimer les frissons, très consommateurs d’énergie. Elle
majore le risque infectieux par immunosuppression.
La crâniectomie décompressive peut être proposée en dernière
intention. Uni- ou bilatérale, elle peut être associée à une lobec-
tomie (4, 9). Cette technique a été évaluée par des études non ran-
domisées, souvent rétrospectives, mais aux résultats encoura-
geants (entre 30 et 55 % de devenir favorable), d’autant qu’elle
est effectuée précocement et chez des patients jeunes, dont le
tableau neurologique initial ne paraît pas d’emblée gravissime
[GCS 3 avec signes d’engagement] (11).
Les corticoïdes ont été proposés pour leurs effets anti-inflam-
matoires. L’indication n’est actuellement plus reconnue.
L’association neuroréanimation intensive et chirurgie de décompres-
sion doit nous conduire à une réflexion éthique permanente sur
l’opportunité des soins et la qualité de vie espérée. Différentes études
évaluant le bénéfice de protocoles de soins médicochirurgicaux
standardisés semblent en faveur d’une amélioration de la survie et
d’une augmentation du pourcentage de patients gardant des séquelles
légères ou modérées. La proportion de patients en état végétatif ou
avec des séquelles lourdes semble diminuer. La mise en place de pro-
tocoles issus des guidelines de la Brain Trauma Fundation semble
même être bénéfique chez des traumatisés crâniens graves dont le
GCS initial est très bas [moyenne 3,6, écart 3-8] (12). Ces don-
nées concernent également les patients bénéficiant d’un volet
décompressif. Plusieurs auteurs semblent cependant ne pas retenir
cette indication chez des patients avec un GCS initial à 3 ou 4 ou
en cas de lésions bilatérales ou touchant le tronc cérébral.
On estime actuellement que 28 % des patients vont garder une
dépendance sévère, 41 % un handicap modéré et 75 % des troubles
du comportement. Seuls 32 % n’ont pas de séquelles physiques
et 72 % peuvent vivre à domicile (3).
Thérapeutiques expérimentales
Différentes molécules (antagonistes calciques, antagonistes du
glutamate, piégeurs de radicaux libres) ont été testées sans
succès dans le but de réduire le stress oxydatif et les effets de
l’accumulation de glutamate. Les derniers espoirs se tournent
vers les cannabinoïdes de synthèse comme le dexanabinol, inhi-
biteur non compétitif du récepteur NMDA, inhibiteur de la pro-
duction de TNF et piégeur des radicaux hydroxyl et peroxyl. Une
récente étude de phase II a montré une tendance à améliorer la
PIC, la PPC et le pronostic (4).
L’utilisation de mannitol 20 % à fortes doses (500 ml) est en
cours d’étude par certaines équipes. Des résultats encourageants
doivent être confirmés.
COMPLICATIONS EXTRACRÂNIENNES
La prise en charge de TC graves concerne également le traite-
ment des traumatismes associés, des pneumopathies acquises
sous ventilation mécanique et de la dénutrition, fréquente chez ces
patients en situation d’hypercatabolisme, ainsi que la prévention
des complications thromboemboliques ou digestives (13). Les
complications hydroélectrolytiques, et notamment les dysnatrémies,
sont fréquentes : hypernatrémie par diabète insipide nécessitant
une compensation des pertes d’eau libre et hormonothérapie sub-
stitutive par Minirin®, hyponatrémie par sécrétion inappropriée
d’hormone antidiurétique ou par syndrome de perte de sel.
CONCLUSION
Devant tout patient traumatisé crânien, la recherche de lésions
associées doit être complète. En cas de polytraumatisme, le trai-
tement de lésions hémorragiques responsables d’un état de choc
est une priorité. C’est avant tout une prise en charge multidisci-
plinaire qui permet l’amélioration du pronostic.
La sévérité des TC graves (mortalité d’environ 30 %, séquelles
lourdes dans environ 40 % des cas) justifie l’organisation de réseaux
de soins allant de la prise en charge préhospitalière jusqu’à la
rééducation en passant par la réanimation et la chirurgie. La réani-
mation est une étape clé. En effet, la lésion primaire, en l’absence
d’une neuroréanimation spécifique, va s’autoaggraver et être à
l’origine de lésions secondaires assombrissant le pronostic.
 6
6
1
/
6
100%