Marco BELLINZONI

SPECIALITE DE MASTER 2
SYSTEMES BIOLOGIQUES & CONCEPTS PHYSIQUES
Universités Paris Diderot, Paris Sud, Pierre et Marie Curie
« PROPOSITION DE STAGE ET/OU DE THESE »
Laboratoire : Unité de Microbiologie Structurale, Institut Pasteur
Adresse : 25 rue du Dr. Roux, 75724 Paris cedex 15
Directeur du laboratoire : Pedro M. Alzari
Équipe de recherche (si pertinent) : Biologie structurale d’enzymes et complexes métaboliques
Responsable de l'équipe : Marco Bellinzoni
Responsable de stage : Marco Bellinzoni
Adresse électronique : marco.bellinzoni@pasteur.fr
N° et intitulé de l’École Doctorale de rattachement : ED436/MTCI
Profil recherché : Biochimiste/Biophysicien avec intérêt pour la biologie structurale
Possibilité de poursuite en thèse : oui
Si oui, financement envisagé : Contrat doctoral (allocation du ministère)
Titre du stage : Interactions protéine/protéine et reconstitution in vitro d’un supercomplexe métabolique de
Corynebacterium glutamicum
Résumé :
Le cycle des acides tricarboxyliques, ou cycle de Krebs, est sans doute l’une des voies métaboliques les plus
connues et les plus conservées. Bien qu’il soit connu depuis 80 ans, des aspects restent à dénicher, notamment
en ce qui concerne la régulation de certains enzymes ou leur organisation dans le temps et l’espace. Par exemple,
selon des hypothèses apparues au cours des années ’80, certains (ou peut-être même la plus part) des enzymes
du cycle de Krebs pourraient être organisés en clusters, ou complexes multienzymatiques [1,2].
Au laboratoire, en étudiant les voies de signalisation chez Mycobacterium tuberculosis, nous nous sommes
intéressés à la régulation du croisement entre le cycle de Krebs et le métabolisme de l’azote (via la synthèse du
glutamate et de la glutamine), un véritable carrefour métabolique qui se situe au niveau de l’intermédiaire α-
ketoglutarate. Ce composé peut en effet donner lieu au glutamate (principalement, chez Mycobacterium, via la
réaction de la glutamine synthétase) ou être converti, au cours du cycle de Krebs, à succinyl-CoA par l’effet du
complexe dit KDH (α-ketoglutarate déshydrogénase). Malgré ce complexe ait été décrit comme absent chez M.
tuberculosis [3], nous savons maintenant non seulement qu’une activité KDH peut être mesurée sous certaines
conditions [4] mais aussi que ce complexe pourrait en réalité ne faire qu’un seul ‘supercomplexe’ avec PDH, le
complexe de la pyruvate déshydrogénase. Ce dernier est impliqué dans la décarboxylation oxydative du pyruvate
issu de la glycolyse et est structuré de la même façon que KDH, avec trois composants (E1p, E2p et E3) qui sont
assemblés autour d’un noyau central fait de 24 ou 60 sous-unités du composant E2p. Par contre, aucun enzyme
E2o (du complexe KDH) a été détecté chez M. tuberculosis [3,4] et le modèle Corynebacterium glutamicum [5],
suggérant ainsi l’existence d’un seul supercomplexe hybride PDH/KDH chez les Corynebacterineae. Réunir ces
deux complexes pourrait générer un assemblage multienzymatique de l’ordre des dizaines de MDa, avec un
diamètre bien supérieur au ribosome et sans analogies chez d’autres organismes.
L’objective de ce stage est d’étudier les interactions protéine-protéine à la base de l’assemblage de ce
supercomplexe, en particulier entre l’enzyme E2p (dihydrolipoamide acétyltransférase), qui est censée former le
cœur du complexe, et les autres composantes, toutes disponibles comme protéines recombinantes exprimées
chez E. coli. L’étudiant(e) pourra donc aisément s’intégrer à ce projet, de la production des protéines à l’étude, en
collaboration avec la Plateforme de Biophysique Moléculaire de l’Institut Pasteur, de leur assemblage, de leur état
d’oligomérisation et de leurs interactions par un éventail de méthodes de biophysique (DLS, MALLS,
ultracentrifugation analytique, ITC, Biacore, SAXS).

SPECIALITE DE MASTER 2
SYSTEMES BIOLOGIQUES & CONCEPTS PHYSIQUES
Universités Paris Diderot, Paris Sud, Pierre et Marie Curie
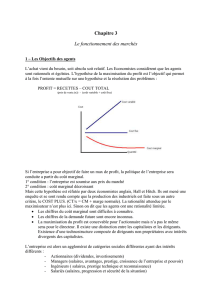
Schéma de la structure de l’hypothétique supercomplexe hybride KDH/PDH chez les Corynebacterineae (qui incluent
Mycobacterium). Les lettres ‘o’ ou ‘p’ désignent l’appartenance des enzymes, selon la situation canonique, au complexe PDH
(‘p’) ou au complexe KDH (‘o’). Au centre (en vert), le composant E2p avec son domaine acetyltransférase C-terminale qui est
censé former le cœur du complexe, avec un état d’oligomérisation (24 ou 60 sous-unités selon les espèces) qui reste à
déterminer. E2p pourrait interagir à la fois avec E1p (bleu) et E3 (jaune), avec lequel il catalyse la réaction de la pyruvate
déshydrogénase, mais aussi avec E1o (rouge) auquel il fournit le groupement lipoyle nécessaire à la réaction
succinyltransférase propre au complexe KDH. A noter, nous avons démontré que l’acétyl-CoA, produit par l’action combinée de
E1p et E2p, est un activateur allostérique de E1o [4].
Références
[1] Robinson, J.B. et Srere, P.A. (1985) J. Biol. Chem. 260: 10800-10805.
[2] Barnes, S.J. and Weitzman, P.D.J. (1986) FEBS Lett. 201: 267-270.
[3] Tian, J., Bryk, R., Shi, S., Erdjument-Bromage, H., Tempst, P., et Nathan, C. (2005) Mol. Microbiol. 57: 859-868.
[4] Wagner, T., Bellinzoni, M., Wehenkel. A., O’Hare, H.M. et Alzari, P.M. (2011) Chem. Biol. 18: 1011-1020.
[5] Hoffelder, M., Raasch, K., van Ooyen, J, et Eggeling, L. (2010) J. Bacteriol. 192: 5203-5211.
!"#$ !%#$
α&'(#)*+(,-,(.$
/#012$
1+&&345*6/#0$
/7"$
809:$
8092$
!";$
!%;$
;5-+<,(.$
/#012$
,&.(5*6/#0$
/7"$
809:$
8092$
Complexe(KDH( Complexe(PDH(
!";$
=">$?$@A$+43(BC$
$!%;$
!%#$
809:$
809:$
Pyruvate(
Acetyl5CoA(
CoASH(
8092$
α5cétoglutarate(
Succinyl5CoA(
CoA5SH(
:(
1
/
2
100%