Résumé de l`étude SAKK 16/08

SAKK 16/08. Chimiothérapie et radiothérapie pré-opératoires combinées
avec le Cetuximab (Erbitux®) chez des patients atteints d’un cancer du
poumon non à petites cellules. Etude multicentrique de phase II.
Résumé du protocole
Le traitement du cancer pulmonaire non à petites cellules localement avancé reste un challenge.
L’importante incidence des rechutes locales ainsi que des métastases est responsables d’un mauvais
pronostic chez ces patients, avec une survie globale à 5 ans estimée entre 3% et 7% pour les tumeurs
inopérables.
Historiquement, les stades III sont subdivisés en deux groupes, le stade IIIA potentiellement opérable
et le stade IIIB traité par radiothérapie ou chimio-radiothérapie, sans chirurgie. Cependant, les
avancées techniques permettent à présent d’opérer une population sélectionnée de patients
présentant un stade IIIB, notamment ceux définis par une atteinte ganglionnaire N3 ou une invasion
locale T4 touchant la carène, l’artère pulmonaire, les corps vertébraux ou la veine cave. Chez ces
patients spécifiques, une thérapie d’induction puis une résection ont permis d’obtenir un taux de survie
à 5 ans de 20 à 30% dans plusieurs études publiées.
Le groupe suisse de recherche contre le cancer (SAKK) travaille à l’amélioration du traitement des
patients présentant un cancer pulmonaire non à petites cellules localement avancé de stade III depuis
plusieurs années. La présente étude devrait permettre de déterminer le meilleur traitement d’induction
pour les patients présentant une tumeur stade IIIB jugée opérable. La combinaison de cisplatine et
docetaxel est un régime d’induction largement utilisé préalablement dans les études du groupe suisse
de recherche SAKK, démontrant une grande efficacité. Dans les stades IIIB, le groupe SAKK a
démontré des résultats parmi les plus favorables dans la littérature à ce jour par l’utilisation de cette
chimiothérapie suivie d’une radiothérapie dans la phase préopératoire. Dans cette étude, le cetuximab
sera adjoint à ce schéma préopératoire, dans l’espoir d’améliorer encore plus avant les modalités de
ce traitement d’induction. Le Cetuximab est un anticorps monoclonal reconnu dans le traitement de
plusieurs formes de tumeurs solides et son efficacité dans le traitement des cancers pulmonaires non
à petites cellules a déjà été mise en évidence. En outre, son utilisation combinée à la chimiothérapie
ou à la radiothérapie semble n’induire que peut d’effets secondaires supplémentaires.
A l’étude sur l’efficacité de la thérapie s’ajoute une analyse de l’utilisation de PET comme outil
pronostic ainsi qu’une recherche translationnelle large qui devrait permettre la corrélation entre les
profils moléculaires de certains patients et leur réponse au traitement.
OBJECTIF
L’objectif principal de cette étude est d’évaluer l’efficacité et la sécurité du traitement séquentiel
néoadjuvant de chimiothérapie et radiothérapie combinées à la thérapie ciblée par cetuximab chez
des patients souffrant d’un cancer du poumon non à petites cellules au stade IIIB opérable.

CRITÈRES D’INTÉRÊTS
Critères d’intérêt principal:
Survie sans progression à une année
Critères d’intérêts secondaires:
Décès liés au traitement durant la chimio-immunothérapie, la radio-immunothérapie ou péri-
opératoire
Réponse métabolique évaluée par PET
Evaluation de la réponse après la chimio-immunothérapie et la radio-immunothérapie
Réponse pathologique complète
Survie globale
Survie sans progression
Effets indésirables
Opérabilité
Résection
Profil de l’échec
Critères d’intérêts des recherches additionnelles:
Polymorphisme des récepteurs Fc
Expression immuno-histochimique de la protéine EGFR au niveau de la tumeur
Amplification du gène EGFR au niveau de la tumeur (analyse par FISH)
Mutations du gène KRAS
Expression immuno-histochimique de la protéine ERCC1
Expression immuno-histochimique de protéine GSTpi
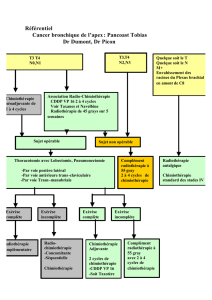
DÉROULEMENT DE L’ÉTUDE
Etude prospective multicentrique de phase II avec au maximum 69 patients évaluables
Enregistrement
Cisplatine 50 mg/m2 à jour 1 et 2 de chaque cycle
Docetaxel 85 mg/m2 à jour 1 de chaque cycle
3 cycles (1 cycles = 21 jours)
Opération
Cetuximab 400 mg/m2 dose initiale à jour 1
250 mg/m2 hebdomadaire à partir de jour 8
12 semaines
Radiothérapie 44 Gy
(PTV 1 = 30 Gy, PTV 2 = 14 Gy)
3 semaines
Suivi

SELECTION DES PATIENTS
Cancer du poumon non à petites cellules au stade IIIB prouvé histologiquement : T4N0-3M0 or
T1-4N3M0 (selon l’appendice 2 du protocole). Sont exclus les stades IIIB stages avec
épanchement pleural ou péricardique malin ; invasion de l’aorte, de l’oesophage, du myocarde ou
atteinte de ganglions supraclaviculaires ou scalènes N3 ; ou encore les stades IIIB définis
uniquement par des lésions satellites dans le même lobe.
Indice de performance 0-1
Patient médicalement apte à supporter le traitement prévu par le protocole, incluant l’opérabilité
Age entre 18 et 75
Consentement éclairé signé
Pas de chimiothérapie ou radiothérapie préalables
DURÉE DE L’ÉTUDE
L’inclusion du premier patient est planifiée pour le 2ème trimestre 2010 et s’arrêtera après l’inclusion de
69 patients qui selon nos estimations devrait avoir lieu au 2ème trimestre 2013. La fin du traitement à
l’étude (dernier patient, dernière visite pour le traitement) est prévue pour le 4ème trimestre 2013.
1
/
3
100%