9 Rencontres d’oncologie des Baux-de-Provence. de la prostate. Place de la chimiothérapie

La Lettre du Cancérologue - Vol. XV - n° 6 - novembre 2006
Réunion
Réunion
316
9es Rencontres d’oncologie des Baux-de-Provence.
Stratégies actuelles dans la prise en charge du cancer
de la prostate. Place de la chimiothérapie
Oncology meeting in les Baux-de-Provence
#P. Beuzeboc*, S. Oudard**
Ces neuvièmes rencontres des Baux-de-Provence avaient pour
but dans la session prostate d’essayer de répondre à des questions
de pratiques quotidiennes en faisant le point sur les stratégies
actuelles. La place de la chimiothérapie y était discutée de façon
pragmatique sous forme de questions/réponses.
EN PRATIQUE
Quel est le moment le plus adéquat
pour utiliser une chimiothérapie ?
Avant l’ère du docétaxel le problème ne se posait pas, la chimio-
thérapie était réservée aux cancers de la prostate métastatiques
hormonorésistants symptomatiques. En effet, avec la mitoxan-
trone il n’avait jamais été rapporté d’amélioration de la survie,
mais seulement une amélioration des symptômes et de la qualité
de vie dans les études de phase III.
Depuis que le docétaxel est devenu la référence de la chimio-
thérapie des formes hormonorésistantes, les indications se
sont-elles modifiées ?
Contre une modification des indications, on peut mettre en
avant certains arguments :
– le bénéfice en termes de médiane de survie globale semble
faible (environ 2 mois) ;
– il faut continuer à privilégier la qualité de vie et les réponses
symptomatiques ;
– il faut respecter (ne pas “voler”) les moments initiaux asymp-
tomatiques de l’échappement hormonal ;
– le rapport bénéfice/risque justifie d’attendre, notamment chez les
patients âgés, avec un état général précaire et des comorbidités.
Comme arguments pour débuter plus précocément, on peut
de même retenir :
– que la tolérance du docétaxel est habituellement acceptable ;
– qu’un traitement plus précoce pourrait permettre une amélio-
ration plus importante de la survie globale, un contrôle meilleur
et plus durable des symptômes ;
– que cette logique prévaut dans la prise en charge de la majorité
des autres cancers métastatiques (sein, côlon, poumon, etc.)
On peut également supposer qu’une meilleure connaissance, à
l’avenir, des facteurs prédictifs de réponse à la chimiothérapie
permettrait de sélectionner les patients pouvant bénéficier d’un
traitement plus précoce (intérêt du temps de doublement du
PSA, par exemple ?).
Les possibilités de réponse à la reprise d’une chimiothérapie à
base de docétaxel chez les bons répondeurs initiaux après un
intervalle libre peuvent aussi être mises en exergue.
Enfin, on peut, avec un optimisme raisonnable, parier sur de
nouvelles armes thérapeutiques dans un avenir proche :
– bénéfices attendus en relais de traitements ciblés : diphospho-
nates, dénozumab, antiangiogéniques, radiothérapie métabo-
lique, inhibiteurs de récepteurs de l’endothéline A ;
– émergence de chimiothérapies potentiellement efficaces en
deuxième ligne : satraplatine, épothilone B, irofulven, etc.
Si l’on devait à partir des données disponibles actuelles répondre
sur le moment le plus adéquat pour commencer une chimio-
thérapie, on ne pourrait que recommander des indications très
“classiques” et réserver les indications aux tumeurs métastati-
ques en échappement hormonal après syndrome de retrait, aux
métastases osseuses symptomatiques.
Pour les métastases non symptomatiques, l’indication ne se
discute pas pour les tumeurs avec métastases viscérales, les
tumeurs indifférenciées à temps de doublement court, a fortiori
les tumeurs à composante neuroendocrine. Dans ces formes, à
côté des exceptionnelles tumeurs anaplasiques à petites cellules,
il faut insister sur l’intérêt du dosage sérique de la chromogranine
A et de la NSE en plus des données immunohistochimiques pour
les diagnostiquer. Un protocole du GETUG mené par le Dr A.
Fléchon du Centre Léon-Bérard de Lyon teste actuellement
une association de carboplatine et d’étoposide en première ou
deuxième ligne (protocole CARBETOP).
Faut-il faire une chimiothérapie seule ou
une association chimiothérapie + hormonothérapie ?
Deux questions différentes se posent en pratique.
Faut-il poursuivre l’hormonothérapie ? Et faut-il utiliser des
associations avec le phosphate d’estramustine ?
À la première question, on peut répondre qu’il est de règle dans
tous les essais thérapeutiques de poursuivre le traitement par
agoniste de la LH-RH, et la pratique quotidienne s’est calquée
sur les études cliniques.
Les réponses à apporter à la deuxième question ne paraissent
pas définitives.
* Département d’oncologie médicale, Institut Curie, Paris.
** Service d’oncologie médicale de l’hôpital européen Georges-Pompidou, Paris.

Probabilité de survie sans maladie
Bras (docétaxel + estramustine)
Bras (docétaxel)
Temps jusqu’à progression (mois)
SSP : Survie sans progression ASCO 2004 - Eymard JC et al., abstract 4603
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
0,2
0,1
0,0 0 2 4 6 8 10 12 14 16 18 20
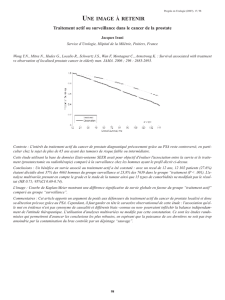
Figure 1.
Étude de phase II randomisée comparant docétaxel ±
estracyt dans les CaP hormonorésistants.
92 patients randomisés :
– Bras A (n = 47) : docétaxel
(70 mg/m2/t3sem.) + estramustine
(560 mg/J, 5J). 1 mg prophylaxis
– Bras B (n = 44) : docétaxel
(70 mg/m2/t3sem.)
– HC (8 mg x 2/J) 3J
Résultats :
– Nombre de cycles médian = 6
– Réponse PSA (Dim ≥ 50 %) :
68,1 % versus 29,5 %
– Réponse objective : 4/22
(18,2 %) versus 3/18 (16 %)
– PSA : 5,7 mois (4,7-6,8)
versus 2,9 mois (2,0-6,9)
Étude
MSKCC 24/47 26/48 –2,0 12,4
USON 70/81 80/85 –11,5 36,1
Aventis 31/48 31/44 –1,9 15,3
Sous-total (a)
125/176 137/177
–15,4 63,8 21 % ± 11
15 % ± 12
19 % ± 8
MDA 28/29 30/30 1,6 13,2
Hoosier 94/94 98/98 –11,5 46,5
Sous-total
Test d’hétérogénéité x2 = 2,07 p = 0,72
Estramustine supérieure Contrôle supérieur
Effet de l’estramustine p = 0,02
Test d’interaction x2 = 0,17 p = 0,68
ASCO 2006 - D’après K. Fizazi, abstract 4561
122/123 128/128
–9,9 59,7
247/299 265/305
–25,3 123,5
(a) Taxanes et épothilone
(b) Vinblastine
Total (a...b)
Nombre
d’événements
estramustine
/ Nombre
inclus
Contrôle O-E Variance
Hazard-ratio
(Estramustine/Contrôle)
Risque
Redn
(±SD)
0,0 0,5 1,0 1,5 2,0
Figure 2.
Améolioration de la survie globale : chimiothérapie +
estramustine versus chimiothérapie seule.
La Lettre du Cancérologue - Vol. XV - n° 6 - novembre 2006
Réunion
Réunion
317
En eff et, l’intérêt de l’addition de phosphate d’estramustine reste
controversé. Si les taux de réponse biologique de l’association
docétaxel + phosphate d’estramustine versus docétaxel sont
supérieurs à ceux du docétaxel seul (70 % versus 50 %), le béné-
fi ce en termes de médiane de survie est apparu équivalent dans
les études de phase III TAX 327 et SWOG 9 916 (de l’ordre de
2 mois pour les deux études). Dans la mesure où cette associa-
tion était responsable d’une toxicité plus élevée avec 15 % de
complications cardiovasculaires dans l’étude du SWOG 9 916 et
un taux de 7 % de thrombophlébites dans une méta-analyse de
23 études (1), elle ne pouvait être retenue comme un traitement
standard de première intention.
Néanmoins, l’étude de phase II randomisée de J.C. Eymard,
comparant chez 92 patients chimio-naïfs présentant un cancer
de prostate hormonorésistant, une association de docétaxel
(70 mg/m²/21 j) + phosphate d’estramustine (560 mg p.o.
pendant 5 jours, administré à la veille de la prise du docétaxel)
au docétaxel seul (75 mg/m²/21 jours), a confi rmé la supério-
rité de l’association en termes de taux de réponse biologique
(deux fois supérieur : 68 % versus 27,3 %) et d’amélioration
de la médiane du temps jusqu’à progression (5,7 mois versus
2,9 mois) [fi gure 1].
La méta-analyse sur données individuelles des essais randomisés
comparant une chimiothérapie par un poison du fuseau (taxanes,
épothilones, vinblastine) avec ou sans phosphate d’estramustine,
rapportée par K. Fizazi (2) a retrouvé un avantage signifi catif en
faveur de l’association en termes de survie globale (p = 0,02).
Ainsi, l’utilisation de la combinaison docétaxel (ou
vinorelbine) + phosphate d’estramustine apparaît-elle comme
une alternative thérapeutique potentiellement effi cace en cas
d’échec ou de réponse non satisfaisante en première intention
avec le docétaxel seul et éventuellement si se pose le problème
de la reprise du docétaxel (fi gure 2).
Est-ce que l’âge est associé
à une augmentation de la morbidité ?
Le cancer de la prostate est une pathologie du sujet âgé. Bien que
le diagnostic soit fait de façon plus précoce du fait de l’extension
du dépistage individuel, les patients restent souvent âgés au
diagnostic. Plus de 70 % des hommes qui présentent un cancer
de la prostate ont plus de 65 ans lors du diagnostic (plus de 60 %
des hommes ont même plus de 70 ans). Néanmoins, beaucoup
de ces hommes avec l’allongement de la durée de vie dans nos
sociétés ont une espérance de vie supérieure à 10 ans (ainsi, la
médiane de survie d’un homme ayant atteint 80 ans est encore
de 7,5 ans en France et en Belgique).
Quand on analyse les résultats thérapeutiques et les toxicités
comparatives des schémas de docétaxel chez les patients de
moins et de plus de 70 ans, on peut constater que le rapport béné-
fi ce/risque est relativement comparable selon les données de W.
Berry et de T.M. Beer rapportées à l’ASCO 2003 (tableau).

La Lettre du Cancérologue - Vol. XV - n° 6 - novembre 2006
Réunion
Réunion
318
L’association avec le zolédronate
en cas de métastases osseuses a-t-il de l’intérêt ?
Les résultats à long terme de l’étude d’enregistrement chez
les 122 patients avec 2 ans de traitement (3) ont montré une
réduction du risque de complications osseuses de 36 % entre
les groupes zolédronate 4 mg et placebo (p = 0,009).
Ces données ont amené en pratique à associer le zolédronate au
docétaxel de façon pragmatique sans que des données tangibles
d’essais sous-tendent cette combinaison.
Pendant combien de temps
un patient doit-il être traité ?
Dans les deux études de phase III TAX 327 et SWOG 9916,
les durées de traitement ont été de 36 et 30 semaines (≈ 10
cycles). Dans les cancers du sein, du poumon, les traitements
d’induction sont souvent de 6 cycles. Le risque d’apparition
de toxicités cumulatives invalidantes (onycholyse, myalgies
et arthralgies, neuropathies périphériques, syndrome de fuite
capillaire), celui de l’induction d’une résistance multidrogue
avec un traitement continu et l’intérêt potentiel de traiter à
nouveau un patient après un intervalle libre long avec la même
chimiothérapie justifient pour beaucoup en pratique de limiter
le traitement initial à 6-8 cycles.
Un traitement intermittent a-t-il de l’intérêt ?
Plusieurs données préliminaires ont montré un intérêt poten-
tiel à une reprise d’un traitement par docétaxel chez les bons
répondeurs initiaux :
– C.H. Ohlmann (ASCO Prostate 2006, abstract 248) a rapporté
son expérience sur 25 patients consécutifs avec un taux de
réponse biologique de 72 % (18/25) et une durée moyenne de
réponse : 5,8 mois (3-10 mois). Cinq patients ont pu bénéficier
d’une reprise du docétaxel ;
– T.M. Beer et al. a rapporté que dans l’étude ASCENT (4) une
reprise du docétaxel a pu être pratiquée chez 18 % des patients
avec une réponse biologique chez 50 % d’entre eux après un
délai médian de 16 semaines après la chimiothérapie initiale
(et 35 % de stabilisation au moins de 12 semaines) ;
– une étude rétrospective (RETAX) réalisée sur les patients
inclus dans des études contrôlées est actuellement en cours,
en France. Les résultats devraient être présentés à l’ASCO
Prostate 2007.
Faut-il proposer un traitement
de clôture après réponse au docétaxel ?
Intérêt potentiel de la radiothérapie métabolique
L’étude de Tu S et al., (5) chez 200 patients traités pour un cancer
hormonorésistant avec une chimiothérapie de type doxorubicine
et randomisés entre poursuite de la chimiothérapie seule ou
associée à une radiothérapie métabolique par strontium (Sr-89)
avait montré un avantage en survie d’un traitement associant
chimiothérapie + Sr-89 en entretien.
Une étude de phase II d’une combinaison de docétaxel + sama-
rium est actuellement conduite en France par K. Fizazi, les
résultats préliminaires ont été rapportés à l’ASCO 2006 (6).
Après une chimiothérapie d’induction par docétaxel et phos-
phate d’estramustine, en cas de réponse ou de stabilisation,
un traitement de consolidation par docétaxel hebdomadaire
(20 mg/m
2
/semaine x 6) était réalisé, associé à une radiothé-
rapie métabolique par une injection de samarium (37 Mbq)
la semaine 1. Les premiers résultats préliminaires rapportés
ont montré un bon contrôle initial des douleurs (60 % après
induction, 70 % après consolidation) avec une toxicité modérée
sur le plan hématologique. Un suivi à distance des douleurs sur
échelle analogique est toujours en cours.
Quel traitement de chimiothérapie
proposer en deuxième ligne ?
De nombreuses molécules ont été testées en deuxième ligne
ou sont en cours d’évaluation, qu’il s’agisse de mitoxantrone,
vinorelbine, étoposide et/ou cyclophosphamide, satraplatine
(résultats en attente de l’étude EORTC, 912 patients), hydroxy-
méthylocyfulvène (seul ou associé à l’oxaliplatine), épothilone B
et apparentés, etc.
PERSPECTIVES
Les nouveaux axes de développement pour le docétaxel
s’orientent à la fois vers des associations avec de nouveaux
traitements ciblés dans les cancers de la prostate hormono-
résistants et vers des utilisations à des stades plus précoces
de la maladie.
Nouvelles associations avec des traitements ciblés
De nouvelles thérapeutiques dites ciblées sont actuellement
disponibles et évaluées chez les patients ayant un cancer de la
prostate hormonorésistant métastatique. En raison d’un grand
nombre de molécules en développement (plus de 70), une
exhaustivité est impossible. Cependant, schématiquement ces
molécules sont évaluées soit en première ligne, en traitement de
maintenance, ou en deuxième ligne après échec du docétaxel.
Il faut relever (figure 3) :
Tableau.
Docétaxel : toxicité par rapport à l’âge.
W. Berry et T.M. Beer
ASCO 2003, abstract 2996
< 70 ans ≥ 70 ans
Bénéce clinique (BC) / /
Réponse biologique
PSA ≥ 50 % 40 % 47 %
Survie globale 11,7 8,7 (p = 0,9)
Toxicité grade 3/4
- hématologique
- non hématologique
12 %
32 %
15 % (p = 0,6)
46 % (p = 0,2)

Docétaxel
PLUS
Inhibiteurs protéasome
- PS341
- bortézomib
Inhibiteurs angiogenèse
- thalidomide/revimid
- bévacizumab
- SU11248, BIBF
Inhibiteurs EGFR
- Erlotinib
- géfitinib
Inhibiteurs PDGF
- imatinib
Antisense
oligonucléotides
- oblimersen
- GTI-2040
Agents ciblant l’os
- ibandronate/zolédronate
- atrasentan
(inhibiteur endotheline-A)
- denozumab
Radio-isotopes
- samarium
inhibiteurs COX-2
Antimétabolites
- capécitabine
- pemetrexed
Agents apoptotiques
- exisulind
- fortes doses calcitriol
Figure 3.
Développement du docétaxel en association avec des
traitements ciblés.
Maladie localisée
à haut risque
CALGB 90203
GETUG12*
SWOG 9921
TAX 3501*
Élévation isolée du PSA
chez des patients à haut risque
ÉTUDE MORRIS
GETUG/ARTIC 03*
Patients métastasiques
naïfs d’HT
ECOG3805
GETUG 15*
Figure 4.
Études randomisées en cours.
RP
R
a
n
d
o
m
i
s
a
t
i
o
n
P
r
o
g
r
e
s
s
i
o
n
P
r
o
g
r
e
s
s
i
o
n
P
r
o
g
r
e
s
s
i
o
n
Bras différé
Début des inclusions : juin 2006
- Critère primaire : SSP
- n = 2 076 (maladie localisée à haut risque, nomogramme de Kattan postopératoire)
- Stratification : âge (≥ 65 versus < 65 ans) predicted prob. of 5-y FFP/pays
Bras immédiat
Leuprolide 18 mois
Observation
Leuprolide 18 mois
Leuprolide 18 mois +
docétaxel x 6 cycles
Leuprolide 18 mois +
docétaxel x 6 cycles
Figure 5.
Adjuvant PC : étude TAX 3501.
Hormonothérapie* (BAC ou BAInc) 3 ans
+
docétaxel 75 mg/m2toutes les 3 semaines
(max. : 9 cycles)
CP loc. à haut risque
• Gleason > 7
• T3
• PSA > 20 ng/ml
* Peut avoir débuté pour traitement de la maladie métastasique jusqu’à 2 mois
maximum avant l’inclusion dans l’étude
Curage de staging
Phase III randomisée
Promoteur : FNCLCC, coordonnateur : K. Fizazi
Inclusions en cours : 380/400 patients
Objectif principal : survie sans progression biologique à 3 mois
(hypothèse : augmentation de 12 % de la SSP
Suivi : 4 ans Hormonothérapie* (BAC ou BAInc)
3 ans
R
a
n
d
o
m
i
s
a
t
i
o
n
Figure 6.
Protocole GETUG 12 dans le cancer de la prostate
localisé à haut risque.
La Lettre du Cancérologue - Vol. XV - n° 6 - novembre 2006
Réunion
Réunion
319
– en association avec le docétaxel dans le cadre d’études de
phase III : bévacizumab, VEGF-Trap, inhibiteur de Bcl2, calci-
triol, inhibiteurs des récepteurs de l’endothéline A, sipuleucel-T,
vaccin GVAX, etc.
– en traitement de maintenance postchimiothérapie : bisphospho-
nates, denozumab, sunitinib, radiothérapie métabolique, etc.
Essais en cours à des stades plus précoces
De nombreux essais sont actuellement activés à des stades plus
précoces dans les cancers métastatiques hormono-naïfs, dans
des formes à haut risque non métastatiques en progression
biologique après échappement hormonal, en rechute biologique
après échec local et en phase néo-adjuvante avant radiothérapie
ou prostatectomie (fi gures 4 et 5).
La grande étude internationale adjuvante TAX 3501 qui doit
inclure 2 076 patients à haut risque de rechute après prostatec-
tomie vient d’être activée.
Les critères d’inclusion sont les suivants :
– adénocarcinome prostatique prouvé histologiquement ;
– pas de métastases décelables ;
– estimation de la survie sans progression à 5 ans < 60 % (nomo-
gramme postopératoire de Kattan) ;
– patient ≥ 18 ans, PS ≤ 1 et espérance de vie > 5 ans ;
– PSA non détectable au moins 30 jours après prostatectomie
(< 0,1 ng/ml) ;
– patient non castré (testostéronémie normale).
Autres essais activés en France
Les inclusions de l’étude GETUG 12 (fi gure 6) vont être termi-
nées à la fi n de l’année ou au début de l’année 2007. Il s’agit de
la première étude néo-adjuvante de phase III réalisée dans le
monde (fi gure 7).
L’étude RISING PSA menée par l’ARTIC et le GETUG concerne
des patients, en rechute biologique après traitement locoré-
gional par chirurgie ou radiothérapie (PSA ≥ 0,2 ng/ml après

Hormonothérapie* (BAC ou BAInc)
jusqu’à androgéno-résistance
+
docétaxel 75 mg/m2toutes les 3 semaines
(max. : 9 cycles)
CP métastasique
androgéno-sensible
* Peut avoir débuté pour traitement de la maladie métastasique jusqu’à 2 mois
maximum avant l’inclusion dans l’étude
Phase III randomisée
Promoteur : FNCLCC et CCAFU, coordonnateur : G. Gravis
Inclusions prévues : 378 patients
Objectif principal : survie globale à 3 ans (hypothèse : 50 % à 65 %)
Suivi : 4 ans Hormonothérapie* (BAC ou BAInc)
jusqu’à androgéno-résistance
R
a
n
d
o
m
i
s
a
t
i
o
n
Figure 8.
Protocole GETUG 15 dans le cancer de la prostate
métastasique hormonosensible.
RT*
* AA pendant 3 semaines pour éviter flare-up biologique
Suspicion rechute locale
Cancer de la prostate
traité localement à haut risque
Élévation du PSA (≥ 0,2 Ch et ≥ 1 ng/ml RT)
Randomisation (1/1)
Suivi PSA et radiologique
Bras chimiothérapie :
Analogue de la LHRH (1 an)*
Docétaxel (6 cycles)
Bras sans chimiothérapie :
Analogue de la LHRH (1 an)*
Figure 7.
Protocole de phase III HT ± CT Rising PSA ARTIC/GETUG.
La Lettre du Cancérologue - Vol. XV - n° 6 - novembre 2006
Réunion
Réunion
320
prostatectomie ou ≥ 1 ng/ml après radiothérapie), défi nis à haut
risque par l’un des critères suivants :
– patients opérés pN+ et/ou marges de résection + ;
– et/ou Gleason ≥ 8 ;
– et/ou temps de doublement du PSA ≤ 6 mois ;
– et/ou temps jusqu’à progression biologique initiale ≤ 1 an ;
– et/ou vélocité PSA > 0,75 ng/ml/an.
Cet essai est également bien avancé et les inclusions devraient
être closes au cours de l’année prochaine (fi gure 8).
La troisième étude s’adresse aux patients en phase métasta-
tique hormono-naïfs (GETUG 15). Les patients peuvent être
randomisés dans cette étude même s’ils ont reçu un traitement
hormonal depuis moins de 2 moins. Environ 385 patients
sont requis pour clore cette étude de phase III comparant une
hormono-thérapie ± docétaxel. L’objectif primaire est la survie
globale.
Conclusion
Le docétaxel constitue maintenant le traitement de référence
dans le cancer de la prostate hormonorésistant et sert de pivot
pour les études d’association avec les nouvelles molécules dites
ciblées. Son évaluation en phase plus précoce de la maladie est
actuellement bien avancée grâce à la réalisation de larges études
de phase III en néo-adjuvant, adjuvant, en phase d’élévation
du PSA et chez les patients hormono-naïfs métastatiques. Les
résultats permettront de défi nir la place du docétaxel aux phases
plus précoces. N
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Lubiniecki GM, Berlin JA, Weinstein RB, Vaughn DJ. romboembolic
events with estramustine phosphate-based chemotherapy in patients with
hormone-refractory prostate carcinoma: results of a meta-analysis. Cancer
2004;101(12):2755-9.
2. Fizazi K, Hudes GR, Berry WR et al. A meta-analysis of individual data from
randomized trials assessing chemotherapy with and without estramustine in pa-
tients with patients with castration-refractory prostate cancer. Proc ASCO 2006,
Abstr 4561.
3. Saad F, Gleason DM, Murray R et al. Long-term effi cacy of zoledronic acid for
the prevention of skeletal complications in patients with metastatic hormone-
refractory prostate cancer. J Natl Cancer Inst 2004;96(11):879-82.
4. Beer TM, Ryan CW, Venner PM et al. Intermittent chemotherapy in metas-
tatic androgen-independent prostate cancer: initial results from ASCENT. Proc
ASCO 2006, Abstr 4518.
5. Tu SM, millikan RE, Mengistu B et al. Bone-targeted therapy for advanced
androgen-independant carcinoma of the prostate : a randomised phase II trial.
Lancet 2001;357(9253):336-41.
6. Laplanche A, Beuzeboc P, Lumbroso M et al. A phase II trial of docétaxel and
samarium in patients with bone metastases from castration-refractory prostate
cancer and a response or stabilization after induction docétaxel-estramustine.
Proc ASCO 2006, Abstr 4608.
28es Journées
d’oncologie pédiatrique
Thème : lymphomes non hodgki-
niens et maladie de Hodgkin de
l’enfant et de l’adolescent
Comité d’organisation :
O. Hartmann, L. Brugières, G. Vassal
Lundi 29 janvier 2007
De 9 h à 17 h 30
Institut de cancérologie
Gustave-Roussy, Villejuif
39, rue Camille-Desmoulins
94805 Villejuif Cedex
Espace Maurice-Tubiana
Inscription obligatoire
Renseignements : Anne-Marie Rivière
Secrétariat de l’enseignement
E-mail : arivière@igr.fr
Tél. : 01 42 11 51 44
Fax : 01 42 11 52 48
Agenda
1
/
5
100%