Ventilation et chirurgie laparoscopique

VENTILATION MECANIQUE AU BLOC OPERATOIRE 51
VENTILATION ET CHIRURGIE LAPAROSCOPIQUE
J-E. Bazin, J-M. Constantin, P. Schoeffler, Département d’Anesthésie–Réanimation,
Hôpital G. Montpied, 63003 Clermont–Ferrand, France.
INTRODUCTION
Depuis dix ans, la cœlioscopie a évoluée vers la réalisation de véritables gestes
chirurgicaux en chirurgie gynécologique, en chirurgie digestive et en urologie.
La moindre agression et les suites opératoires plus simples de cette technique chi-
rurgicale la font proposer à des patients de plus en plus âgés et porteurs de pathologies
cardiovasculaires et respiratoires, mais le pneumopéritoine et la position, nécessaires à
la visualisation chirurgicale, induisent des répercussions physiopathologiques (dont nous
n’aborderons ici que l’aspect respiratoire) tout à fait particulières qui conditionnent la
prise en charge anesthésique.
1. CONSEQUENCES RESPIRATOIRES PEROPERATOIRES
1.1. HYPERCAPNIE
Le CO2 est actuellement préféré aux autres gaz pour créer le pneumopéritoine. Ses
propriétés physico-chimiques réduisent, en effet, les conséquences d’une éventuelle
embolie gazeuse. Cependant la grande solubilité de ce gaz et la perméabilité du péritoi-
ne favorisent sa diffusion en dehors de la cavité péritonéale et son absorption dans la
circulation systémique. Par ailleurs, l’élévation du diaphragme secondaire à l’hyper-
pression intra-abdominale peut modifier la distribution de la ventilation et de la perfusion
pulmonaire. Ces conséquences laissent présager des altérations des échanges gazeux.
De fait, une augmentation de la PaCO2 est classiquement décrite pendant les cœliosco-
pies gynécologiques [1, 2]. Le mécanisme de l’élévation de la PaCO2 est multifactoriel
et nous allons en analyser les différents composants.
1.1.1. ABSORPTION DE CO2
Une absorption de CO2 à partir de la cavité péritonéale survient autour de la
10ème minute après le début de l’insufflation, pour atteindre un plateau vers la 20ème
minute [3] cet état stable étant le résultat de l’équilibre entre la quantité de dioxyde de
carbone qui diffuse à partir de la cavité péritonéale et celle qui est éliminée par voie
pulmonaire. La réabsorption correspond à 15 à 30 % de la production métabolique [2, 3].
Cette réabsorption ne semble exister, de plus, que pour des pressions intrapéritonéales
basses [4], et elle est rapidement limitée par le collapsus des vaisseaux péritonéaux. Il

MAPAR 199952
a été montré qu’en maintenant une PaCO2 constante, l’élimination de CO2 était aug-
mentée pendant le pneumopéritoine mais aussi après son exsufflation lors de la
décompression des vaisseaux péritonéaux.
Des absorptions de CO2 massives peuvent être observées lors d’insufflations extra-
péritonéales : rétropéritonéales ou sous-cutanées accidentelles [3]. L’emphysème
sous-cutané lié à une diffusion du CO2 peut entraîner une élévation importante du CO2
artériel et donc une élévation du CO2 expiré. Au cours d’une insufflation volontaire-
ment extra-péritonéale de CO2, la PaCO2 et la PETCO2 sont augmentées de façon plus
importante et durable qu’au cours d’une insufflation péritonéale [3].
1.1.2. MODIFICATIONS DE LA MECANIQUE THORACO-PULMONAIRE
L’élévation de pression intra-abdominale et, à un moindre degré, les changements
de positions provoquent des perturbations de la mécanique respirato
ire. Les pressions
des voies respiratoires augmentent, et la compliance du système respiratoire diminue [2, 5].
Au cours de laparoscopies gynécologiques, la compliance est diminuée de 20 % par la
position de Trendelenburg et de 30 % par l’élévation de p
ression intra-abdominale [5].
La compliance pulmonaire dynamique diminue proportionnellement à l’augmentation
de pression intra-abdominale aussi bien en position de Trendelenburg qu’en position
proclive.
En comparant la compliance respiratoire totale en position de Trendelenburg
ou en position proclive, Oikkonen et coll [6] ont montré que la création d’un pneumopé-
ritoine diminuait la compliance de 20 % dans les deux groupes. Cependant la position de
Trendelenburg diminuait la compliance respiratoire totale de 20 % supplémentaires alors
qu’elle ne varie pas en position proclive. Le retour à une compliance normale a été im-
médiat après exsufflation chez les patients en position proclive alors que cette récupération
est incomplète chez les patients ayant été opérés en position de Trendelenburg. L’imp
é-
dance mécanique du poumon et de la paroi thoracique augmentent avec la pression
intra-abdominale [7]. Cette augmentation est dépendante du morphotype et est plus
importante en position de Trendelenburg [7]. Elle ne persiste pas après exsuflation [7].
Au total, le pneumopéritoine diminue d’environ 20 % la compliance respiratoire
totale. Celle-ci est encore diminuée par la position de Trendelenburg, cette position
implique une diminution de la compliance persistante même après exsufflation.
1.1.3. ALTERATIONS DU RAPPORT VENTILATION/PERFUSION
Ces modifications semblent surtout intervenir lors de pressions d’insufflation péri-
tonéales élevées, comme le montre l’hypercapnie observée lors d’insufflations d’hélium
dans la cavité péritonéale chez des porcs [4]. En ventilation contrôlée l’insufflation
péritonéale s’accompagne d’une élévation des pression de plateau dans les voies respi-
ratoires, alors que le débit cardiaque diminue [8], concourant à une augmentation de
l’effet espace mort [2]. Cette augmentation de l’espace mort devrait se traduire par un
élargissement du gradient entre PaCO2 et pression de CO2 mesurée en fin d’expiration
da
ns les gaz expirés (PETCO2). En effet, la dilution des gaz provenant d’alvéoles bien
perfusées par ceux des alvéoles mal perfusées diminue la PETCO2 tandis que la réduction
de la ventilation alvéolaire au profit de celle de l’espace mort augmente la PaCO2. Au cours
du pneumopéritoine, le gradient Pa-ETCO peut augmenter [9], rester stable [2, 10, 11, 12, 13]
ou diminué si la PaCO2 est supérieure à 41 mmHg. Il semble en fait que, chez les patients
ASA
I ou II non insuffisants respiratoires chroniques en position proclive, l’effet espace
mort soit négligeable. Un élargissement du gradient PaCO
2
-PETCO
2
est en revanche re-
trouvé en position de Trendelenburg [2, 13], lors de prolongation de l’intervention [14], de
pathologies cardiovasculaires et d’obé
sité.

VENTILATION MECANIQUE AU BLOC OPERATOIRE 53
En utilisant la méthode du «single breath test CO2» en couplant la fraction expirée
de CO2 et le volume expiré Bures et coll apportent quelques éclaircissements sur ces
mécanismes [10]. En effet cette méthode permet l’appréciation graphique de l’espace
mort alvéolaire, et la ventilation alvéolaire à partir de la production de CO
2
(VCO
2
) et de
la fraction alvéolaire en CO
2
. La ventilation était maintenue constante 96 mL.kg
-1
.min
-1
et le pneumopéritoine à 12 mmHg. Chez les 15 patients ASA I ou II de l’étude, la PETCO
2
et la VCO
2
ont augmenté, le gradient PaCo
2
- PETCO
2
est resté positif et non modifié
chez 7 patients, et était diminué, voire négatif
chez 8 patients au cours du pneumopéri-
toine. Il n’existe pas de modification de la ventilation alvéolaire moyenne. L’espace-mort
physiologique et l’espace-mort alvéolaire établi chez 7 patients sont restés inchangé.
Ces auteurs concluent donc que, chez des patients ASA I et II, seul le CO2 réabsorbé
augmente la fraction expirée de CO2 au cours d’un pneumopéritoine de 12 mmHg et
avancent l’hypothèse que de grands volumes de CO2 insufflé favorisent un gradient
négatif entre la PaCO2 et la PETCO2.
1.2. OXYGENATION
L’augmentation de la pression intra-abdominale, en modifiant les échanges gazeux
par compression des régions basales et postérieures du poumon à l’origine d’atélecta-
sies, pourrait faire suspecter un effet shunt. Cependant, il a été montré que la consommation
d’oxygène n’était pas modifiée au cours du pneumopéritoine [5, 15] et que l’oxygéna-
tion n’était pas modifiée, voire même augmentée au cours du pneumopéritoine [15]. De
plus, l’admission veineuse n’est pas modifiée par le pneumopéritoine [15]. Dans cette
étude, les auteurs émettent l’hypothèse que la création du pneumopéritoine s’accompa-
gnerait d’une pression positive de fin d’expiration mais ceci n’est pas démontré.
2. VENTILATION CONTROLEE
Le pneumopéritoine la rend obligatoire. Les paramètres ventilatoires seront réglés
sur les données de la capnographie [9]. Une augmentation de la ventilation minute d’en-
viron 30 % permet généralement de maintenir une normocapnie. Cette adaptation sera
autant que possible obtenue en jouant sur la fréquence pour éviter de trop fortes pres-
sions trachéales et des mouvements diaphragmatiques trop amples en sachant cependant
que l’augmentation de ventilation/minute pour maintenir une normocapnie sera plus
importante en modifiant la fréquence respiratoire par rapport au volume courant [5]. Le
fait de rajouter une pression expiratoire positive inférieure à 5 mmHg ne modifie pas de
manière sensible les répercussions hémodynamiques du pneumopéritoine et s’oppose à
la baisse de la CRF.
Le maintien d’une normocapnie n’est pas toujours possible chez les patients ayant
une fonction cardiorespiratoire altérée ou en cas d’insufflation extrapéritonéale. Il n’exis-
te pas de données permettant de définir une limite «acceptable» de PaCO2 et d’acidose
respiratoire cliniquement tolérable. Il semble cependant qu’une valeur de pH de 7,20 et
une PaCO2 de 65 mmHg soient des valeurs limites raisonnables en absence de contre-
indications classiques de l’hypercapnie telle que l’hypertension intracrânienne.
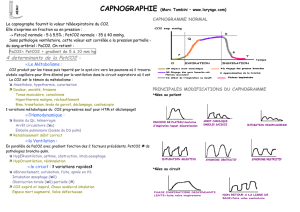
3. CAPNOGRAPHIE
La pression télé-expiratoire en CO2 (PETCO2) est le témoin de la production de gaz
carbonique par le métabolisme cellulaire, de l’absorption de celui-ci à partir de la cavi-
té péritonéale, de son transport et des échanges pulmonaires. Comme nous l’avons vu,
le gradient entre la PETCO2 et la PaCO2 peut lui aussi varier au cours de la laparosco-
pie. Toute modification brutale de la PETCO2 traduit une complication :

MAPAR 199954
• une élévation rapide de quelques millimètres de mercure revenant en quelques minu-
tes aux chiffres de base, peut être le témoin d’embolies gazeuses minimes de CO2;
• une élévation plus progressive et durable dans le temps traduit souvent une diffusion
extrapéritonéale du CO2 (pré-péritonéale, sous-cutanée, rétropéritonéale, média-sti-
nale…). Cet accroissement du CO2 expiré se prolonge parfois plusieurs heures au-delà
de l’exsufflation du pneumopéritoine et justifie la surveillance de la capnographie en
salle de réveil ;
• toute perturbation circulatoire diminuera l’expiration de CO2. Une baisse rapide de
PETCO2 peut traduire une chute du débit cardiaque ou une diminution du retour
veineux, mais aussi une oblitération artérielle pulmonaire.
• Plus que l’hypercapnie, la chute brutale du CO2 expiré traduit toujours une complica-
tion grave.
Les changements de position comme le Trendelenburg ou le décubitus latéral peu-
vent modifier la valeur de la PETCO2.
L’évaluation parfois incorrecte de la PaCO2 par la PETCO2 a fait proposer le moni-
torage du CO2 transcutané qui serait un meilleur reflet de la PaCO2 mais qui pose un
certain nombre de problèmes techniques. Chez les patients à risque et en cas de varia-
tions importantes de la PETCO2 ou des paramètres hémodynamiques, la mesure de la
PaCO2 s’impose. La surveillance continue et parallèle de la PETCO2 et de la PaCO2
pourrait être d’un très grand intérêt pour la surveillance des retentissements physiopa-
thologique du pneumopéritoine.
4. COMPLICATIONS RESPIRATOIRES PEROPERATOIRES
4.1. EMPHYSEME SOUS-CUTANE
L’emphysème sous-cutané est assez fréquent, il peut parfois être massif et atteindre
le visage. Souvent en rapport avec une fuite pré- ou rétropéritonéale à partir d’un tro-
cart, son diagnostic est fait sur l’élévation de CO2 expiré et sur la visualisation de
l’emphysème. Il impose au chirurgien de revérifier tous les points de pénétration des
trocarts et de baisser si cela est possible la pression d’insufflation. Dans la période
postopératoire, ces emphysèmes peuvent être responsables d’une hypercapnie persis-
tante et de douleurs. En règle générale, la réabsorption de ces emphysèmes est
relativement rapide en quelques heures.
4.2. INTUBATION SELECTIVE
Une intubation sélective peut aussi être à l’origine d’une hypercapnie et doit être
évoquée systématiquement. Elle est liée au pneumopéritoine et à la position de Trende-
lenburg qui refoule le diaphragme et entraîne une ascension de la carène [16].
4.3. PNEUMOTHORAX
Il peut résulter d’un barotraumatisme, lié à l’hyperpression intrathoracique ou d’un
passage de gaz carbonique de la cavité abdominale vers la plèvre, à l’occasion d’une
brèche chirurgicale (chirurgie œsophagienne le plus souvent). Des malformations con-
génitales mettant en contact la cavité pleurale et la cavité abdominale ont aussi été
évoquées pour rendre compte de ces «capnothorax». La diffusion de CO2 dans le thorax
à été plusieurs fois décrite, surtout dans la chirurgie proche du hiatus œsophagien. Fré-
quemment, peu symptomatiques et de diagnostic fortuit, ces épanchements peuvent
prendre un caractère compressif dramatique (élévation des pressions respiratoires,
hypercapnie majeure, syndrome cave supérieur, collapsus...) qui impose l’exsufflation

VENTILATION MECANIQUE AU BLOC OPERATOIRE 55
rapide du pneumopéritoine ou pour certains l’introduction d’une pression expiratoire
positive [17].
4.4. EMBOLIE GAZEUSE
L’incidence de l’embolie gazeuse est faible, estimée entre 0 et 0,6 % des cœlio-
chirurgies. En fait, il est vraisemblable que les formes frustes, qui se manifestent par
des troubles neurologiques non spécifiques ou par un simple retard de réveil soient
beaucoup plus nombreuses. Elles peuvent aussi se confondre avec les autres complica-
tions hémodynamiques de la cœliochirurgie, comme les obstacles aigus au retour veineux
ou les troubles du rythme, sans compter avec les formes retardées qui surviennent à la
fin de l’intervention, lorsque l’exsufflation du pneumopéritoine libère des bulles de
CO2 piégées dans la circulation mésentérique ou portale.
Le volume de l’embol gazeux conditionne la symptomatologie clinique. Seules les
embolies de faible débit (inférieur à 0,3 ml/kg chez le chien) s’accompagnent d’une
augmentation de la PETCO2 qui traduit l’élimination du CO2 intravasculaire par l’émonc-
toire pulmonaire. Lorsque le volume de l’embol gazeux augmente, la PETCO2 chute,
par diminution des échanges au niveau du lit capillaire pulmonaire et/ou par arrêt circu-
latoire.
La porte d’entrée se situe le plus souvent au niveau d’une grosse veine (veine ilia-
que, veine cave inférieure), ponctionnée lors de la mise en place de l’aiguille de Palmer
en début d’insufflation. Un autre point d’entrée se situe au niveau des plexus veineux
péri-ombilicaux. Les plaies vasculaires peropératoires ne conduisent à une embolie
gazeuse que si la pression du pneumopéritoine est très proche de la pression veineuse.
Si elle est supérieure, comme c’est le cas le plus souvent en cœliochirurgie, le collapsus
des vaisseaux empêche toute entrée de gaz. Dans les rares situations où la pression
veineuse est supérieure à la pression du pneumopéritoine, la brèche vasculaire s’ac-
compagne d’une hémor-ragie [18].
La pollution du CO2 intra-abdominal par du protoxyde d’azote diffusant à partir du
circuit anesthésique ou de l’oxyde de carbone provenant du bistouri électrique aggrave
les répercussions de l’embolie gazeuse car ces gaz sont moins solubles que le CO2
(toute suspicion d’embolie gazeuse implique le passage à une FiO2= 100 %). Néan-
moins, la faible incidence des embolies gazeuse au cours de la chirurgie laparoscopique
ne justifie pas d’écarter systématiquement le protoxyde d’azote des protocoles anesthé-
siques mais seulement l’interruption de son administration en cas de suspicion d’embolie
gazeuse. La persistance de communication inter-auriculaire chez 30 % des sujets
jeunes peut expliquer les embols systémiques et des complications neurologiques
.
Les mesures prophylactiques sont essentielles et doivent être appliquées systémati-
quement. Il s’agit des tests d’aspiration réalisés lors de mise en place de l’aiguille de
Palmer, mais aussi du recours à une «open laparoscopy» lorsqu’une difficulté d’insuf-
flation est prévisible (abdomen multi-opéré). D’une manière plus générale, il est
important de limiter le débit d’insufflation à un litre par minute aussi longtemps que
celle-ci est aveugle. L’utilisation d’un doppler œsophagien ou précordial, ou à défaut
d’un simple stéthoscope est utile pour détecter précocement une embolie gazeuse dans
les situations à risque.
5. CAS PARTICULIERS
5.1. PATHOLOGIES RESPIRATOIRES
Les variations de la mécanique ventilatoire et surtout des pressions intrathoraciques
induites par l’augmentation de pression intra-abdominale peuvent constituer des limi-
 6
6
 7
7
 8
8
1
/
8
100%

![Anesthésie pour chirurgie robotisée.pd[...]](http://s1.studylibfr.com/store/data/006673693_1-2f789fc2d519d513da63c69972e0de73-300x300.png)








