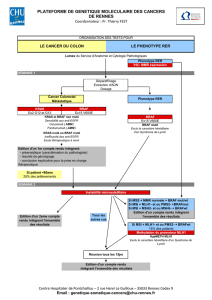
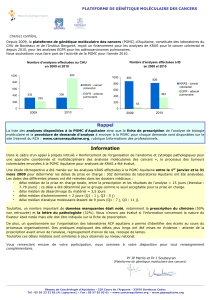
ONCOLOGIE TRANSLATIONNELLE // Coordonné par S. Faivre

166 | La Lettre du Cancérologue • Vol. XIX - n° 3 - mars 2010
ONCOLOGIE
TRANSLATIONNELLE
Coordonné par S. Faivre
(hôpital Beaujon, Clichy)
C. Tournigand
(hôpital Saint-Antoine, Paris)
// Journal of Clinical Oncology
// British Journal of Cancer
Biologie moléculaire
et chimiothérapie dans le cancer
du côlon métastatique
Richman SD, Seymour MT, Chambers P, Elliott F, Daly CL,
Meade AM, Taylor G, Barrett JH, Quirke P. KRAS and BRAF mutations
in advanced colorectal cancer are associated with poor prognosis
but do not preclude benefit from oxaliplatin or irinotecan: results
from the MRC FOCUS trial. J Clin Oncol 2009;27(35):5931-7.
F
luoro-uracile, oxaliplatine et irinotécan sont
les 3 molécules majeures formant la base du
traitement par chimiothérapie du cancer du côlon.
La recherche de biomarqueurs prédictifs de la
réponse et de la survie a été réalisée concernant les
thérapies anti-EGFR (récepteur de l’EGF). Ainsi, de
nombreuses études ont montré l’absence de béné-
fi ce d’un traitement par anti-EGFR chez les patients
porteurs d’une tumeur présentant une mutation du
gène KRAS. La présence d’une mutation du gène
BRAF semble aussi être un biomarqueur de réponse
aux anti-EGFR, mais cela n’a pas été confi rmé dans
une étude prospective. Concernant la réponse à
la chimiothérapie conventionnelle, aucune étude
n’a mis en évidence le rôle des mutations KRAS
ou BRAF. L’essai FOCUS
(Fluorouracil, Oxaliplatin,
CPT11 [irinotecan], Use and Sequen-
cing)
a permis d’étudier les statuts
mutationnels de KRAS et de BRAF
chez des patients traités par chimio-
thérapie sans thérapie ciblée, et les
valeurs pronostique et prédictive de
ces mutations, indépendamment
des thérapies anti-EGFR. Le statut
MSI a aussi été étudié.
Entre 2000 et 2003, 2 135 patients
porteurs d’un cancer du côlon
avancé ont été randomisés dans l’essai MRC FOCUS,
qui consistait en la comparaison de différentes
séquences de chimiothérapie, comportant 5-FU,
irinotécan et oxaliplatine. Les objectifs de l’étude
étaient la survie sans progression (SSP) et la survie
globale (SG). Parmi les 1 425 patients inclus dans
le groupe traité par 5-FU seul suivi de l’associa-
tion 5-FU/irinotécan ou 5-FU/oxaliplatine et dans
le groupe traité par la seule association 5-FU/
irinotécan ou 5-FU/oxaliplatine, 711 avaient du
tissu tumoral primitif disponible pour l’étude molé-
culaire. Les mutations des codons 12, 13 et 61 du
gène KRAS et du codon 600 du gène BRAF ont été
recherchées par la technique de pyroséquençage
et confi rmées par la méthode de séquençage par
Sanger. L’expression de MLH1 a été étudiée à partir
de TMA
(tissue microarray)
par immunohistochimie.
43,3 % des patients présentaient une mutation des
codons 12, 13 ou 61 du gène KRAS, et 7,9 % une
mutation du gène BRAF. Les mutations des gènes
KRAS seul ou BRAF seul n’ont pas d’effet sur la SSP,
mais étaient pronostiques d’une diminution de
la SG (HR = 1,24, p = 0,008 pour KRAS ; HR = 1,82,
p < 0,0001 pour BRAF). La présence d’une mutation
à la fois de KRAS et de BRAF était pronostique d’une
diminution de la SG (HR = 1,40, p < 0,0001). Par
contre, la présence d’une mutation de KRAS seul ou
de BRAF seul n’était pas prédictive de la survie sous
traitement à base d’irinotécan ou d’oxaliplatine. Le
statut MSI a été déterminé chez 686 patients. Une
perte de l’expression de MLH1 a été retrouvée chez
2,8 % d’entre eux. Une association a été retrouvée
entre la présence d’une mutation BRAF et la perte
d’expression de MLH1 (p = 0,012).
Cette étude prospective randomisée permet de
mettre en évidence l’absence de valeur prédictive
des mutations KRAS et BRAF pour la survie sous
chimiothérapie sans thérapie ciblée, dans le cancer
du côlon avancé. Alors que la présence d’une muta-
tion KRAS est désormais une contre-indication au
traitement par anticorps anti-EGFR, les patients
porteurs d’une mutation KRAS ou BRAF présen-
tent une survie équivalente à celle des patients
non mutés sous chimiothérapie. Cette donnée est
importante dès lors que les données de biologie
moléculaire permettent d’orienter le choix des
traitements notamment des thérapies ciblées, dans
le cancer du côlon.
C. Massard, université Paris XI,
SITEP (Service des innovations
thérapeutiques précoces) ;
département de médecine,
Institut Gustave-Roussy, Villejuif ;
Royal Marsden Hospital,
Institute of Cancer Research, Sutton,
Surrey, Royaume-Uni
Biologie moléculaire dans
le cancer du colon métastatique
et anti-EGFR
Laurent-Puig P, Cayre A, Manceau G, Buc E, Bachet JB, Lecomte T,
Rougier P, Lievre A, Landi B, Boige V, Ducreux M, Ychou M, Bibeau F,
Bouché O, Reid J, Stone S, Penault-Llorca F. Analysis of PTEN,
BRAF, and EGFR status in determining benefit from cetuximab
therapy in wild-type KRAS metastatic colon cancer. J Clin Oncol
2009;27(35):5924-30.
L
a présence d’une mutation KRAS est prédic-
tive d’une absence de réponse et d’une survie
Le statuts KRAS et BRAF
pourraient être pronostiques
mais ne prédisent pas
le bénéfi ce de la chimiothérapie
cytotoxique dans le cancer
du côlon

La Lettre du Cancérologue • Vol. XIX - n° 3 - mars 2010 | 167
plus courte chez les
patients traités par les
anticorps antirécep-
teurs de l’EGF (EGFR)
pour un cancer du côlon métastatique. La prescrip-
tion des anticorps anti-EGFR (cétuximab et pani-
tumumab) est désormais restreinte aux patients
présentant une tumeur avec le gène KRAS sauvage.
KRAS n’est pourtant pas un biomarqueur parfait,
car seulement la moitié des patients porteurs d’une
tumeur KRAS sauvage bénéfi cient du traitement.
Cette étude propose de s’intéresser aux autres
éventuels biomarqueurs de l’effi cacité des anti-
EGFR que sont les gènes de l’EGFR, PTEN et BRAF,
connus pour être altérés dans le cancer du côlon.
Les tumeurs de 173 patients atteints d’un cancer
du côlon ont été collectées de façon rétrospective,
dans 6 hôpitaux. La majorité des patients ont reçu
du cétuximab en association avec de l’irinotécan.
Les objectifs de l’étude sont la réponse basée sur
les critères RECIST (Response Evaluation Criteria in
Solid Tumors), la survie sans progression (SSP) et
la survie globale (SG). Les 7 plus fréquentes muta-
tions des codons 12 et 13 du gène KRAS ainsi que
la mutation V600E du gène BRAF ont été étudiées
par la méthode de discrimination allélique utilisant
des sondes TaQman®. Une CISH (hybridisation chro-
mogénique in situ) a été réalisée sur l’ensemble
des tumeurs pour rechercher la présence d’une
amplifi cation du gène de l’EGFR, la positivité de
l’amplifi cation étant confi rmée par la méthode
de FISH (hybridisation in situ par fl uorescence).
L’expression de PTEN était déterminée par immu-
nohistochimie (IHC).
31,3 % des patients présentaient une mutation
activatrice du gène KRAS. Comme attendu, la
présence de la mutation était fortement prédic-
tive de l’absence de réponse (p < 0,001), avec une
SSP plus courte (p < 0,001) et une SG plus courte
(p < 0,001). Trois pour cent des tumeurs présen-
taient une mutation du gène BRAF, et étaient aussi
KRAS sauvage. Chez les patients KRAS sauvage,
la mutation BRAF était associée à l’absence de
réponse, mais pas de façon signifi cative (p = 0,063).
Par contre, elle était très signifi cativement asso-
ciée à une SSP plus courte (p < 0,001) et à une
SG également plus courte (p < 0,001). Une poly-
somie ou amplifi cation du gène de l’EGFR a été
retrouvée chez 22 des 138 patients dont la tumeur
a été analysée. Dans le sous-groupe des patients
KRAS sauvage, le phénotype FISH+ était associé
à un taux de réponse plus élevé que lorsque le
nombre de copies
de l’EGFR était
normal (71 %
versus 37 %,
p = 0,015). Si les SSP et SG associées à ce phéno-
type tendaient à être plus courtes, la différence
n’était pas signifi cative. Concernant l’expression
de PTEN, dans le sous-groupe des patients KRAS
sauvage, la perte de PTEN était associée à une SG
plus courte (p = 0,013) mais pas à la réponse ni à la
SSP. En analyse multivariée, EGFR et BRAF étaient
prédictifs de la réponse de façon signifi cative.
PTEN et BRAF étaient conjointement prédictifs
de la SG.
Cette étude met en évidence 3 facteurs autres que
les mutations du gène KRAS associés à la réponse
et/ou à la survie des patients traités par anti-EGFR
pour un cancer du côlon métastatique : la mutation
BRAF, l’amplifi cation de l’EGFR et l’expression de
PTEN. Ainsi, plusieurs éléments de la voie de signa-
lisation de l’EGFR semblent être impliqués dans la
réponse aux anti-EGFR. Ces données doivent être
confi rmées, notamment par une étude prospec-
tive. La connaissance de la biologie moléculaire des
cancers du côlon pourra permettre, dans les années
à venir, de disséquer les mécanismes de réponse et
de résistance aux traitements, et ainsi de proposer
un traitement personnalisé aux patients.
C. Massard, université Paris XI,
SITEP (Service des innovations
thérapeutiques précoces) ;
département de médecine,
Institut Gustave-Roussy, Villejuif ;
Royal Marsden Hospital,
Institute of Cancer Research, Sutton,
Surrey, Royaume-Uni
Nouvelle thérapie
antiangiogénique
Lockhart AC, Rothenberg ML, Dupont J, Cooper W, Chevalier P,
Sternas L, Buzenet G, Koehler E, Sosman JA, Schwartz LH,
Gultekin DH, Koutcher JA, Donnelly EF, Andal R, Dancy I, Spriggs DR,
Tew WP. Phase I study of intravenous vascular endothelial growth
factor trap, aflibercept, in patients with advanced solid tumors.
J Clin Oncol 2010;28(2):207-14.
L’
angiogenèse est un mécanisme majeur
impliqué dans la carcinogenèse. La voie du
VEGF a un rôle capital, et l’action en particulier du
VEGF-A est médiée par les récepteurs VEGFR-2 et
VEGFR-1 exprimés au niveau des cellules endothé-
liales des vaisseaux ou au niveau des cellules tumo-
rales. Plusieurs modèles expérimentaux ont montré
que l’activation de la voie VEGF-VEGFR induit une
prolifération des vaisseaux, une perméabilité et
une migration. De plus, depuis le concept avancé
par Judah Folkman, plusieurs études précliniques
et de grandes études de phase III ont démontré la
validité du concept d’inhibition de l’angiogenèse,
et en particulier de celui d’inhibition de la voie
VEGF-VEGFR, dans les tumeurs humaines. À ce jour,
plusieurs agents sont enregistrés dans des cancers
métastatiques comme ceux du poumon, du sein, du
côlon, du rein, du foie : les inhibiteurs de tyrosine
kinase multicibles ciblant en particulier le VEGFR
(sunitinib, sorafénib), et un anticorps monoclonal
ciblant le VEGF (bévacizumab).
Cependant, même si ces thérapies sont effi caces,
la plupart des patients développent des résistances
à ces traitements et fi nissent par progresser. De
nouvelles approches sont nécessaires. L’étude de
phase I du VEGF Trap développée par Regeneron
Pharmaceuticals et Sanofi -aventis, a été publiée
en début d’année dans le
Journal of Clinical Onco-
logy
. Le VEGF Trap est une protéine recombinante
constituée de domaines du VEGFR-1 et du VEGFR-2
fusionnés avec le fragment Fc d’une immunoglo-
buline. Le VEGF Trap est donc un antagoniste
circulant du VEGF, qui bloque le VEGF et inhibe
son interaction avec son récepteur.
La phase I a inclus 47 patients avec des tumeurs
solides avancées, traités avec des doses croissantes
de 0,3 à 7 mg/kg par voie intraveineuse toutes les
2 semaines. Les toxicités limitantes ont été une
ulcération rectale et une protéinurie à la dose
de 7 mg/ kg. Ainsi, la dose recommandée pour ce
produit est de 4 mg/kg toutes les 2 semaines. Les
autres toxicités rapportées sont celles qu’ordinai-
rement comportent les thérapies antiangio-
géniques : dysphonie (46,8 %), hypertension
artérielle (38,3 %) et protéinurie (10,6 %).
De plus, 3 réponses partielles selon les critères
RECIST ont été observées chez des patients
(1 patient avec un thymome et 2 patientes avec
un cancer de l’ovaire). En outre, 2 patients porteurs
d’un cancer du rein ont présenté une stabilité
tumorale prolongée de plus de un an.
Dans cette étude, l’évaluation de la réponse tumo-
rale était faite par un scanner standard, mais aussi
par une imagerie fonctionnelle de type DCE-IRM.
Cette IRM fonctionnelle est utilisée pour mettre en
évidence des effets sur la perméabilité vasculaire
et la perfusion tumorale ; elle a montré une dimi-
nution de la vascularisation tumorale 24 heures
La détermination du statut
KRAS n’est que le début
du démembrement
moléculaire
du cancer du côlon

168 | La Lettre du Cancérologue • Vol. XIX - n° 3 - mars 2010
ONCOLOGIE
TRANSLATIONNELLE
après l’administration du médicament, ce qui met
en évidence l’effet antiangiogénique attendu. Ce
type d’examen pourrait permettre
de mettre en évidence des profi ls de
réponse différents selon la sensibi-
lité des tumeurs aux traitements, et
d’identifi er précocement les patients
répondeurs à cette thérapeutique.
De nombreuses études d’association
de chimiothérapies avec le VEGF Trap
ont été réalisées par la suite. De plus,
plusieurs études de phase III sont en
cours actuellement avec le VEGF Trap, en parti-
culier dans le cancer du pancréas, du poumon ou
de la prostate.
C. Massard, université Paris XI,
SITEP (Service des innovations
thérapeutiques précoces) ;
département de médecine,
Institut Gustave-Roussy, Villejuif ;
Royal Marsden Hospital,
Institute of Cancer Research, Sutton,
Surrey, Royaume-Uni
Vers une meilleure
compréhension
de la biologie du cancer
de la prostate : nouveaux
facteurs pronostiques ?
Reid AH, Attard G, Ambroisine L, Fisher G, Kovacs G, Brewer D,
Clark J, Flohr P, Edwards S, Berney DM, Foster CS, Fletcher A,
Gerald WL, Møller H, Reuter VE, Scardino PT, Cuzick J, de Bono JS,
Cooper CS; Transatlantic Prostate Group. Molecular characterisation
of ERG, ETV1 and PTEN gene loci identifies patients at low and high
risk of death from prostate cancer. Br J Cancer 2010;102(4):678-84.
U
ne meilleure connaissance de la biologie des
cancers de la prostate a permis l’identifi ca-
tion de nombreuses anomalies molécu-
laires qui, pour certaines d’entre elles,
constituent de possibles cibles théra-
peutiques. La découverte de gènes de
fusion impliqués dans le cancer de la
prostate a d’importantes implications
biologiques et cliniques. La fusion du
gène TMPRSS2 avec le gène ETS a été
rapportée par Tomlins et al. en 2005
comme le premier gène de fusion dans
les cancers de la prostate, ce qui a depuis été
confi rmé par plusieurs équipes indépendantes.
La détection de la translocation TMPRSS2 et ERG
dans le tissu du cancer de la prostate peut être
utilisée comme un biomarqueur pour le déve-
loppement clinique. Les gènes impliqués sont le
gène TMPRSS2, régulé par les androgènes, et les
gènes de la famille des facteurs de transcription
ETS, comme ERG, ETV1 ou ETV4. La transloca-
tion TMPRSS2-ERG est la plus fréquente, présente
dans 40 à 80 % des cancers de la prostate. Une
autre voie de signalisation importante dans le
cancer de la prostate est la voie PI3K/Akt/mTOR.
Plusieurs études suggèrent qu’elle est activée
dans 30 à 50 % des cancers de la prostate, le plus
souvent à cause de la perte de PTEN.
Ainsi, l’étude de la translocation TMPRSS2-ERG et
la perte de PTEN pourraient permettre de redé-
fi nir le pronostic des patients atteints de cancer
de la prostate métastatique, mais aussi localisé.
À l’heure du débat sur le dépistage par le PSA
du cancer de la prostate, la possibilité de mieux
défi nir le pronostic des patients ayant un cancer
de la prostate localisé est cruciale.
Récemment, l’équipe du Royal Marsden Hospital
a montré l’intérêt de l’étude des recombinaisons
ERG/ETV1 et de la perte de PTEN pour mieux
défi nir le pronostic des patients ayant un cancer
de la prostate localisé. Reid et al. ont déterminé le
statut PTEN et ERG/ETV1 chez plus de 300 patients
atteints de cancer de la prostate localisé non traité
(surveillance seule). En analyse multivariée, le statut
ERG/ETV1 ou PTEN n’est pas corrélé à la survie.
Cependant, le groupe le plus important de patients
(54 %) ayant une perte de PTEN et une absence de
recombinaison a un très bon pronostic en l’absence
de traitement (85,5 % de longs survivants, après
un suivi de 11 ans). À l’inverse, les patients ayant
une absence de recombinaison et une perte de
PTEN (6 %) ont un pronostic très péjoratif (13,7 %
de longs survivants).
Cette étude rétrospective doit être validée par
une autre série, et idéalement dans une étude
prospective. Cependant, la détermination du
statut TMPRSS2-ERG et PTEN pourrait permettre
de mieux stratifi er les patients, d’adapter leur prise
en charge après le dépistage ou un diagnostic
précoce et de mieux choisir entre traitement actif
et surveillance.
C. Massard, université Paris XI,
SITEP (Service des innovations
thérapeutiques précoces) ;
département de médecine,
Institut Gustave-Roussy, Villejuif ;
Royal Marsden Hospital,
Institute of Cancer Research, Sutton,
Surrey, Royaume-Uni
Le VEGF Trap est un nouvel
antiangiogénique très
prometteur, son activité
antitumorale s’exerçant
dans les cancers de l’ovaire
et du rein
La translocation TMPRSS2-ERG
et la délétion PTEN pourraient
permettre de mieux stratifi er
les patients atteints d’un cancer
de la prostate localisé
1
/
3
100%