e traitement conservateur du cancer du sein est (7)

e traitement conservateur du cancer du sein est
devenu plus fréquent, en raison de la détection plus
précoce des lésions primitives (dépistage, meilleure
information des femmes). Le curage ganglionnaire sous-pecto-
ral reste justifié par la nécessité d’obtenir des informations sur
le statut ganglionnaire du lit tumoral, facteur pronostique
majeur pour la décision thérapeutique (1). Devant une majorité
de petites tumeurs pour lesquelles la probabilité de l’atteinte
ganglionnaire est faible se pose aujourd’hui le problème de
minimiser l’étendue du curage ganglionnaire sans faire courir
un risque carcinologique important à la patiente.
Avant de discuter des possibilités actuelles, il convient de
revenir sur un article récent de Barth (2). L’étude des seules
caractéristiques histologiques et biologiques de 918 tumeurs
primitives est suffisamment précise pour recommander la dis-
section ganglionnaire axillaire uniquement chez les femmes
dont la lésion a une taille supérieure à 1 cm.
L’idéal serait de disposer d’une méthode permettant un dia-
gnostic de métastase ganglionnaire avant le traitement chirur-
gical. Il n’y a pas de méthode d’imagerie traditionnelle qui
pourrait d’une façon efficace détecter avec certitude la pré-
sence d’une métastase ganglionnaire axillaire du cancer du
sein. Des essais d’imagerie isotopique dans le cancer du sein,
réalisés au moyen de substances radioactives colloïdales non
spécifiques (3, 4, 5) ou d’anticorps spécifiques (6), se sont avérés
imprécis, avec une sensibilité et une spécificité toujours infé-
rieures à 90 %, et ne peuvent être retenus. Peut-on espérer faire
mieux et comment ?
LES MOYENS DE LA VISUALISATION INDIRECTE
DU SYSTÈME LYMPHATIQUE
Utilisées depuis plus d’un siècle pour l’étude de l’anatomie
descriptive du système lymphatique, les méthodes de visuali-
sation indirectes n’ont cessé de se développer, en particulier
grâce à la compréhension de la physiologie du système lym-
phatique. Elles sont passées successivement des colorants
toxiques non vitaux aux colorants vitaux puis aux substances
inertes radioactives.
Les colorants vitaux
La première utilisation chez l’homme vivant date de 1923,
durant une intervention chirurgicale dans le but de repérer et
de décrire le système lymphatique (7). Successivement seront
utilisés le bleu patenté violet en solution isotonique à 11 % (8),
le bleu ciel pontamine (9), le bleu Evans (10, 11), suivis de
l’utilisation de substances fluorescentes (12, 13), de l’encre de
chine (14) ou du charbon actif (15). La survenue de réactions
secondaires avec ces colorants vitaux, en raison de la quantité
utilisée, favorise la recherche d’autres molécules, notamment
isotopiques.
Les substances colloïdales radioactives
L’utilisation des radiocolloïdes pour l’étude du système lym-
phatique commence avec Seaman qui étudie la distribution
d’un colloïde d’or radioactif dans les ganglions (16). Le col-
loïde se situe dans le tissu lymphoïde normal et les ganglions
totalement envahis par la tumeur ne sont pas imprégnés. Dans
le but d’éviter des interventions chirurgicales mutilantes,
Hultborn (17) étudie la distribution de l’or colloïdal radioactif
injecté dans le cancer du sein. Le transport du colloïde s’effectue
préférentiellement par la chaîne mammaire externe (85 %), et
de façon complémentaire par la voie transpectorale (10 %) et
la voie mammaire interne (5 %). L’abandon des colloïdes d’or
pour des colloïdes marqués au technétium 99m va permettre de
mieux connaître les conditions du transport lymphatique d’une
substance particulaire inerte injectée dans le tissu conjonctif
(18, 19, 20, 21, 22). Le transport est fonction de la forme phy-
sico-chimique de la substance (particulaire ou colloïdale), de la
taille des particules qui doit être comprise entre 4 et 80 nm, du
volume injecté qui doit rester faible pour ne tracer qu’un seul
territoire et de l’activité colloïdopexique des macrophages tis-
sulaires.
NOUVELLES PERSPECTIVES DE DÉTECTION
GANGLIONNAIRE
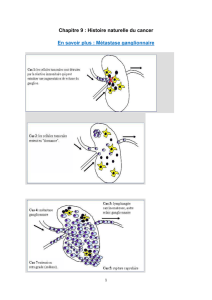
Le repérage durant l’intervention du ganglion sentinelle,
premier ganglion dans le territoire du drainage lymphatique
tumoral qui sera prélevé et analysé, est en évaluation. Les
études publiées entre 1993 et 1996 sur la valeur prédictive de
l’atteinte du ganglion sentinelle du cancer du sein sont nom-
breuses. Elles utilisent soit un colorant particulaire repérable
visuellement (bleu patenté), soit un colloïde radioactif détec-
table durant l’intervention au moyen d’un détecteur miniatu-
risé, soit des anticorps monoclonaux spécifiques radioactifs
détectables avant et pendant l’intervention, ou encore des
indicateurs ganglionnaires ou tumoraux injectés par voie
générale.
ÉDITORIAL
47
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
Le ganglion sentinelle : perspectives
●
A.P. Pecking*, F.J. Bertrand*, S. Yacoub*, C. Corone*, J.R. Garbay*
*Centre René-Huguenin, Saint-Cloud.
L
vol VII/n°2 avr. 23/04/04 10:03 Page 47

Radiolocalisation chirurgicale du ganglion sentinelle dans le
cancer du sein
L’expérience réussie de Morton (23) dans le mélanome malin
a été reprise dans le cancer du sein pour la première fois par
Krag en 1993 (24). Un colloïde de technétium est injecté par
voie péritumorale à 22 patientes avec une détection peropéra-
toire du premier relais du drainage tumoral positive pour
18 patientes (82 %). L’état histologique standard (HES) du
ganglion sentinelle prélevé est en corrélation parfaite avec la
prédictivité de l’état histologique des autres ganglions. Il n’y a
aucun faux négatif et pour 3 patientes, le ganglion sentinelle
était le seul pathologique. Le repérage du ganglion sentinelle
est fiable par cette méthode peropératoire avec une sensibilité
de 100 %.
Localisation chirurgicale du ganglion sentinelle dans le
cancer du sein
Une première étude dans le cancer du sein est publiée en 1994
(25). Un colorant inerte, bleu violet (isosulfan), est injecté en
péritumoral sur un groupe de 172 patientes comparé à
134 patientes n’ayant pas reçu d’injection. Le repérage per-
opératoire du premier relais bleu a été possible sur
114 patientes (66 %) avec un total de 207 ganglions senti-
nelles. Cette étude introduit un biais méthodologique impor-
tant : l’examen histologique est réalisé sur les ganglions senti-
nelles, en coupes sériées, avec les colorations standards (HES)
et une étude immunohistochimique, contrairement au reste du
curage. Il y a plus de métastases dans le groupe ganglion
sentinelle que dans l’autre, ce qui pouvait être naturellement
attendu de l’association coupes sériées et étude immunohisto-
chimique à l’examen histologique standard. Il n’en demeure
pas moins qu’en utilisant cette approche histologique et immu-
nohistochimique, 109 ganglions sentinelles ont permis de pré-
dire le statut du reste du curage (95,6 %). La méthode a été un
échec dans 5 cas où le ganglion prélevé était négatif alors qu’il
existait une métastase à distance (4,4 %). Enfin, Giulano
constate que dans 23 % des cas, le drainage lymphatique tumoral
s’effectue directement dans le deuxième étage de Berg.
Les expériences de détection du ganglion sentinelle se sont
rapidement développées avec soit l’utilisation du colorant
inerte seul, soit l’utilisation de colloïdes radioactifs seuls, soit
l’association des deux. Une remarque est d’emblée nécessaire :
il s’agit d’une technique qui nécessite un apprentissage. Deux
approches méthodologiques sont utilisées. La première est
l’injection préopératoire du traceur choisi (25, 26, 27, 28, 29,
30, 31, 32), la seconde est une injection de colloïdes radioactifs
avec repérage à la peau effectuée la veille d’une injection de
colorant en préopératoire associée à une chirurgie radioguidée
(33, 34, 35, 36). Le point principal est le taux de faux négatifs
produit par la méthode. Le tableau I résume ces expériences.
Les conclusions des chirurgiens sur cette méthode au Congrès
de la Société américaine de chirurgie sont rapportées par la
présidente de la Société internationale de médecine nucléaire
(28) :
– la localisation du ganglion sentinelle peut être réalisée avant
toute incision ;
– une incision petite peut suffire pour pratiquer rapidement et
aisément la biopsie de ce ganglion ;
– la morbidité du curage axillaire est minimisée, particulière-
ment si le ganglion sentinelle est négatif, ce qui permettrait de
ne pas réaliser le curage complet ;
– le staging initial est amélioré par rapport au staging habituel ;
– cette méthode génère des économies de santé.
Malgré les espérances réelles liées à cette méthode, elle reste
une investigation en développement qui nécessite une coopéra-
tion parfaite, multidisciplinaire, associant chirurgie, anatomie
et cytologie pathologiques et médecine nucléaire (36).
Radiolocalisation chirurgicale spécifique des ganglions du
territoire de drainage
L’utilisation d’anticorps spécifiques radioactifs injectés par
voie intraveineuse a été réalisée dans le cancer du sein sans
succès. La localisation de l’anticorps au sein de la tumeur cible
vérifiée par méthode immunohistochimique (38) a justifié la
poursuite de cette approche. Une seule étude avec un anticorps
humain marqué a été réalisée dans le cancer du sein. Après une
injection au niveau de l’aréole aux 31 patientes, un repérage
préopératoire par imagerie, suivi d’un contrôle ex vivo de la
pièce de curage et des ganglions isolés, a été réalisé. Les résul-
tats ont été corrélés par une étude histologique et immunohis-
tochimique (39, 40). La valeur prédictive est de 90 % avec un
nombre important de ganglions hyperplasiques positifs dans
les petites tumeurs, situation clinique où il serait important
d’avoir un résultat exact du statut ganglionnaire afin d’éviter
un curage inutile. Cette étude se focalise sur des modifications
morphologiques en histologie mais dont la signification n’est
toujours pas éclaircie. Les résultats obtenus sont suffisamment
encourageants pour générer d’autres études et pratiquer la
détection peropératoire spécifique du ganglion sentinelle.
Localisation des ganglions par un traceur radioactif général
La méthode qui permettrait de réaliser la détection sélective du
ganglion métastatique est peut-être arrivée. L’utilisation du
fluoro-désoxyglucose marqué par du fluor 18, émetteur de
positons, pour la détection de la tumeur primitive autant que
ÉDITORIAL
48
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
Isotope + bleu = isotope 24 heures avant l’intervention et bleu en
préopératoire, bleu + isotope = injection des deux composés en
préopératoire.
Médium Cas Ganglions Valeur Faux
sentinelles prédictive négatifs
Krag (24) 1993 isotope 22 18 100 % 0 %
Giulano (25) 1994 bleu 174 114 95,6 % 4,4 %
Albertini (27) 1996 bleu + isotope 62 57 100 % 0 %
Statman (29) 1997 bleu 174 114 96 % 4 %
Giulano (30) 1997 bleu 107 100 100 % 0 %
Guenther (31) 1997 bleu 145 103 97,1 % 2,9 %
Borgsein (32) 1997 isotope + bleu 33 33 100 % 0 %
Veronesi (34) 1997 isotope + bleu 163 160 95 % 5 %
Pijpers (35) 1997 isotope + bleu 37 34 91,9 % 8,1 %
Rodier (36 ) 1997 bleu 51 39 86,9 % 5,8 %
Tableau I.
Analyse de la littérature récente du ganglion sentinelle
dans le cancer du sein.
vol VII/n°2 avr. 23/04/04 10:03 Page 48

pour l’envahissement ganglionnaire semble possible. Cette
méthode est la première qui réalise un bilan complet en un seul
examen avec, pour la détection des ganglions pathologiques du
cancer du sein, une efficacité globale de 95 %. La comparaison
avec d’autres méthodes isotopiques actuellement en évaluation
comme le Sestamibi est à l’avantage de la tomographie à posi-
tons (41, 42).
LE GANGLION SENTINELLE : ASPECT ANATOMO-
PATHOLOGIQUE
Cette nouvelle approche conservatrice du traitement chirurgi-
cal des petits cancers du sein où l’envahissement métastatique
est souvent limité à l’existence de micrométastases doit être
discutée en tenant compte du besoin du clinicien et des
réponses apportées par l’anatomo-pathologiste. Si l’existence
d’une micrométastase est retenue comme facteur péjoratif par
le clinicien, il convient d’être certain de ne pas l’ignorer. Le
matériel ganglionnaire prélevé est réduit à un ou deux gan-
glions : se pose alors le problème du choix de méthodes histo-
logiques à mettre en œuvre.
La rentabilité des coupes sériées et de l’utilisation addition-
nelle de la technique d’immunomarquage est en moyenne de
16,7 % sur l’ensemble des études publiées, avec, dans deux cas
sur trois, un impact sur le devenir du patient. Il apparaît donc
indispensable d’étudier le ganglion sentinelle par coupes
sériées et immunohistochimie lorsqu’il est normal en histolo-
gie standard. Mais peut-on réaliser une corrélation convenable
et, à terme, se contenter de l’exérèse du seul ganglion senti-
nelle alors que le reste du curage n’est étudié qu’en histologie
standard ? Peut-on ne pas prendre en considération le risque de
micrométastases ignorées dans le reste du curage ?
Enfin, cette approche histologique sera-t-elle suffisante ? Ou
devra-t-on avoir recours aux nouvelles techniques de biologie
moléculaire pour amplifier le signal anormal de la micrométas-
tase et minimiser encore les risques de la méconnaître, comme
le suggère Schoenfeld (43), qui montre l’existence d’un groupe
de patientes pour lesquelles le recours à des méthodes de bio-
logie moléculaire semble indispensable ?
CONCLUSION
L’utilisation de la détection peropératoire de l’association col-
loïde radioactif et colorant inerte permet d’espérer réaliser une
chirurgie sélective du creux axillaire en ne prélevant que le
groupe ganglionnaire sentinelle.
Elle reste toutefois en évaluation et ne doit être réalisée
qu’après un apprentissage rigoureux dans des centres possé-
dant une équipe multidisciplinaire entraînée.
La discussion doit tenir compte des micrométastases et de leur
signification pour ne pas risquer de se trouver dans une situa-
tion qui serait jugée carcinologiquement non satisfaisante.
La validation de la prédictivité du statut histologique du gan-
glion sentinelle sur le résultat histologique du reste du curage
passe par l’utilisation de la même méthode d’évaluation pour
l’ensemble des ganglions étudiés.
Cette réflexion peut déboucher sur le recours à des techniques
qui font appel à la biologie moléculaire, ainsi que sur l’étude
des modifications environnementales du parenchyme gan-
glionnaire précédant l’envahissement métastatique.
L’impact de cette nouvelle attitude chirurgicale sur la survie
reste inconnu. Le gain de 2 à 3 % sur le taux d’œdèmes secon-
daires du membre supérieur est-il suffisant pour justifier cette
nouvelle approche ? ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Fisher B., Wolmark N., Redmond C. et coll. Findings from NSABP Protocol
No. B04 : comparison of radical mastectomy with alternative treatments. II.
The clinical and biologic significance of medialcentral breast cancers. Cancer
1981 ; 48 : 1863-72.
2. Barth A., Craig P.H., Silverstein M.J. Predictors of axillary lymph node
metastases in patients with T1 breast carcinoma. Cancer 1997 ; 79 : 1918-22.
3. Gabelle P.H., Comet M., Bodin J.P. et coll. La lymphoscintigraphie
mammaire par injection intra-tumorale dans le bilan du cancer du sein. Nouv
Presse Med 1981 ; 10 : 3067-70.
4. Ege G.N. Internal mammary lymphoscintigraphy. Radiology 1976 ; 118 :
101-7.
5. Mac Lean R.G., Ege G.N. Prognostic value of axillary lymphoscintigraphy in
breast carcinoma patients. J Nucl Med ; 27 : 1116-24.
6. DeLand F.H., Kim E.E., Corgan R.L. et coll. Axillary lymphoscintigraphy by
radioimmunodetection of carcinoembryonic antigen in breast cancer. J Nucl
Med 1979 ; 20 : 1243-50.
7. Braithwaite L.R. Flow of lymph from ileocecal angle. Br J Surg 1923 ; 7 :
11-3.
8. McMaster P.D., Parsons R.J. Physiological conditions existing in connective
tissue : methods of interstitial spread of vital dyes. J Exp Med 1939 ; 69 : 247-56.
9. Weinberg J.A., Greaney E.M. Identification of regional node by means of vital
staining during surgery of gastric cancer. Surg Gyn Obst 1950 ; 90 : 561-5.
10. Sauer I., Bacon H. A new approach excision of carcinoma of the lower
rectum and anal canal. Surg Gyn Obst 1952 ; 95 : 229.
11. Gallico E., Giacomelli V., Pricolo V. La colorazione vitale dei limfatici
nella chirurgia dei tumori. Chirurgia 1954 ; 9 : 303-6.
12. Schlegel J.U. Demonstration of blood vessels and lymphatics with a
fluorescent dye in ultraviolet light. Anat Recod 1949 ; 97 : 105-9.
13. Monti M.R., Borreani B., Ghezzi P. La fluorescenza idott de ematoporfirina
in oncologia. Basi teoriche e generalita. Arch Zilliken 1964 ; 9 : 3-27.
14. Isozaki H. Clinical studies on perigastric lymphatic flow and lymph node
metastasis of gastric cancer. J Osaka Med Coll 1985 ; 44 : 103-26.
15. Seiki K., Takahashi T., Sawai K., Hagiwara A., Taniguchi H., Shioaki Y.,
Yoneyama C. A new treatment for metastatic lymph nodes of cancer using
carbon particles (CH40) adsorbing ethanol. Progress in lymphology XII, ICS
887. 1990 ; 607-8.
49
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
Figure 1. Exploration ex vivo d’un ganglion sentinelle et du reste du
curage ganglionnaire sous-pectoral. Le ganglion sentinelle à droite est
nettement radioactif.
vol VII/n°2 avr. 23/04/04 10:03 Page 49

16. Seaman W.B., Powers W.E. Studies on the distribution of radioactive
colloidal gold in regional lymph nodes containing cancer. Cancer 1955 ; 8 :
1044-6.
17. Hultborn K.A., Larsson L.G., Ragnhurt I. The lymph drainage from the
breast to the axillary and parasternal lymph nodes studied with the aid of
Au 198. Acta Radiol 1955 ; 43 : 52-64.
18. Anghileri L.J. Lymph node distribution of several radiocolloides migration
ability through the tissues. J Biol Nucl Med 1967 ; 11 : 180-4.
19. Prasasvinichai S., Honda T., Nedwich A., Lam S., Brady L.W. Observation
on the transport mechanism of colloidal gold. Radiol Clin Biol 1973 ; 42 : 460-7.
20. Levy M.H., Wheelock E.F. The role of macrophages in defense against
neoplastic disease Ad. Cancer Res 1974 ; 20 : 131-4.
21. Bergqvist L., Strand S.V., Person B.R. Particle sizing and biokinetics of
interstitial lymphoscintigraphic agents. Semin Nucl Med 1983 ; XIII : 9-19.
22. Pecking A.P., Ledoussal V., Cluzan R., Desprez-Curely J.P., Lasry S.,
Leclerc M., Guerin P. Comportement d’un colloïde radioactif injecté dans le
tissu interstitiel de l’homme. In : Circulation d’échange et de retour. Boots (ed.)
1984 ; 133-49.
23. Morton D.L., Wen D.R., Wong J.H. et coll. Technical details of
intraoperative lymphatic mapping for early stage melanoma. Arch Surg 1992 ;
127 : 392-9.
24. Krag D.N., Weaver D.L., Alex J.C., Fairbank J.T. Surgical resection and
radiolocalization of the sentinel lymph node in breast cancer using a gamma
probe. Surg Oncol 1993 ; 2 : 335-40.
25. Giulano A.E., Kirgan D.M., Guenther J.M., Morton D.L. Lymphatic
mapping and sentinel lymphadenectomy for breast cancer. Ann Surg 1994 ;
220 : 391-401.
26. Giulano A.E., Dale P.S., Turner R., Morton D.L. Improved axillary staging
of breast cancer with sentinel lymphadenectomy. Ann Surg 1995 ; 222 : 391-
401.
27. Albertini J.J., Lyman G.H., Cox C., Yeatman T., Balducci L., Ku N. et coll.
Lymphatic mapping and sentinel node biopsy in the patients with breast cancer.
JAMA 1996 ; 276 : 1818-22.
28. Alazraki N., Eshina D., Eshina L.A., Herda S.C., Murray D.R., Vansant
J.P., Taylor A. Lymphoscintigraphy, the sentinel node concept and the
intraoperative gammaprobe in melanoma, breast cancer and other potential
cancers. Sem Nucl Med 1997 ; 27 : 55-67.
29. Statman R., Giulano A.E. The role of the sentinel lymph node in the
management of patients with breast cancer. Advances Surg 1997 ; 30 : 209-21.
30. Giulano A.E., Jones R.C., Brennan M., Statman. Sentinel lymphadenectomy
in breast cancer. J Clin Oncol 1997 ; 15 : 2345-50.
31. Guenther J.M. Sentinel lymphadenectomy for breast cancer in a community
managed care setting. Cancer J Sci Am 1997 ; 3 : 336-40.
32. Borgstein P.J., Meijser S., Pijpers R. Intradermal blue dye to identify
sentinel node in breast cancer. Lancet 1997 ; 349 : 1668-9.
33. Thompson J.F. Sentinel node biopsy. J Surg Oncol 1997 ; 66 : 270-2.
34. Veronesi U., Paganelli G., Galimberti V., Viale G., Zurrida S., Bedoni M. et
coll. Sentinel node biopsy to avoid axillary dissection in breast cancer with
clinically negative lymph nodes. Lancet 1997 ; 349 : 1864-7.
35. Pijpers R., Meijers S., Hoekstra O.S., Collet G.J., Conrans E.F.I., Boom
R.P.A. et coll. Impact of lymphoscintigraphy on sentinel node identification with
technetium 99m colloidal albumin in breast cancer. J Nucl Med 1997 ; 38 : 366-8.
36. Rodier J.F., Janser J.C. Surgical technical details improving sentinel node
identification in breast cancer. Oncol Report 1997 ; 4 : 281-3.
37. Morton D.L. Intraoperative lymphatic mapping and sentinel
lymphadenectomy : community standard care or clinical investigation ? Cancer
J Sci Am 1997 ; 3 : 328-30.
38. Bertrand-Gougeon F.J., Champy C., Pecking A.P., Rouëssé J. Are the
results of radio-immunolymphoscintigraphy with monoclonal antibodies
correlated with histological reality. Progress in Lymphology XII. Excerpta
Medica ICS 994. 1992 ; 303-6.
39. Bertrand F.J., Pecking A.P., Murray J.H., Lokiec F.M., Champy O.,
Boudinet A. et coll. The association of micrometastase with positive lymph
nodes detected in breast cancer patients by radioimmunolymphoscintigraphy
using an indium labeled human monoclonal antibody 1688. Proc Am Ass
Cancer Res 1992 ; 33 : abst. 1288.
40. Pecking A.P., Gougeon-Bertrand F.J., Lokiec F.M., Murray J.H.,
Subramanian R., Boudinet A., Floiras J.L. et coll. Radioimmuno-
lymphoscintigraphy in the preoperative staging of primary breast cancer : a
pilot study using a human monoclonal antibody (LiLo-16.88). Int J Oncol
1996 ; 9 : 659-67.
41. Bombardieri E., Crippa F., Maffioli L. et coll. Axillary lymph node
metastases detection with nuclear medicine approaches in patients with newly
diagnosed breast cancer : can positron emission tomography (PET) with
18FDG be considered as the best method ? Int J Oncol 1996 ; 8 : 693-9.
42. Crippa F., Agresti R., Seregni E., Greco M., Pascali C., Bogni A. et coll.
Prospective evaluation of fluorine 18 FDG-PET in presurgical staging of the
axilla in breast cancer. J Nucl Med 1998 ; 39 : 4-8.
43. Schoenfeld A., Luqmani Y., Smith D., O’Reilly S., Shousha S., Sinnett H.D.,
Coombes R.C. Detection of breast cancer micrometastases in axillary lymph
nodes by using polymerase chain reaction. Cancer Res 1994 ; 54 : 2986-90.
ÉDITORIAL
50
La Lettre du Cancérologue - volume VII - n° 2 - mars-avril 1998
vol VII/n°2 avr. 23/04/04 10:03 Page 50
1
/
4
100%