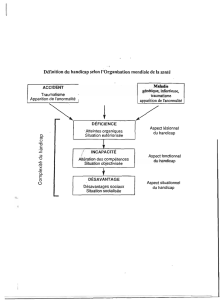
U P A T H O L O G I E ...

PATHOLOGIE MUSCULAIRE
La Lettre du Neurologue - Hors-série - avril 2002 5
U
n déficit moteur bilatéral de la ceinture pelvienne,
d’installation progressive, est dans la majorité des
cas le témoin d’une souffrance musculaire primitive.
La connaissance de plus en plus précise de la cellule musculaire,
de son fonctionnement, de ses protéines constitutives, structu-
relles et enzymatiques, s’est accompagnée d’une révision de la
nosologie de ces maladies. Les entités suivantes peuvent être
individualisées :
–les dystrophies musculaires, congénitales ou non, dont la
classification repose sur la nature de la protéine altérée
(tableau p. 6). Depuis la découverte de la dystrophine et de
son gène, ont également été identifiées les protéines du com-
plexe sarcoglycanes, puis d’autres protéines sarcolemniques
(dysferline, cavéoline), des protéines cytosoliques (calpaïne
3), sarcomériques (myotiline, téléthonine), nucléaires
(lamine, émerine, etc.), et de la matrice extracellulaire (méro-
sine, etc.) ;
–d’autres myopathies héréditaires, qu’elles soient congénitales,
métaboliques, inflammatoires (en particulier, les myosites à
inclusion) ou de mécanisme encore inconnu (myopathie proxi-
male myotonique : PROMM) ;
–les myopathies acquises inflammatoires (polymyosites, myo-
sires à inclusions) et, plus rarement, iatrogènes (statines, AZT,
etc.).
Confirmer l’origine myogène d’un déficit moteur pelvien est en
règle générale facile grâce au dosage des enzymes musculaires
et à l’électromyographie. En revanche, en préciser l’étiologie est
souvent difficile, voire impossible, avant la réalisation d’une
biopsie musculaire (études histologiques et moléculaires) et
d’une étude génétique. Toutefois, la recherche des antécédents
personnels et familiaux, l’étude de l’éventuel mode de transmis-
sion, l’âge de début des symptômes, la topographie du déficit et
de l’amyotrophie, la présence de signes associés (myotonie, car-
diopathie, rétractions précoces, etc.) permettent d’orienter le
diagnostic.
Le premier élément d’orientation est le mode de transmis-
sion. Si l’on exclut la myopathie myotubulaire de révélation
néonatale, les myopathies liées à l’X se résument aux dystro-
phies musculaires de Duchenne (DMD) et de Becker (BMD).
Une transmission autosomique récessive oriente vers une dys-
trophie musculaire par déficit en sarcoglycanes, dysferline, cal-
païne ou téléthonine, ou vers certaines myopathies congénitales
ou métaboliques, une transmission autosomique dominante vers
un déficit en myotiline, lamine ou cavéoline 3 ou vers une
PROMM. Les formes sporadiques peuvent être inflammatoires,
métaboliques ou iatrogènes.
L’origine ethnique du patient peut constituer un élément
d’orientation, avec une fréquence plus élevée des dystrophies
musculaires par déficit en γ-sarcoglycanes dans les familles tzi-
ganes ou du Maghreb, et des dystrophies par déficit en calpaïne
sur l’île de la Réunion.
L’âge de début de la symptomatologie peut être un élément
d’orientation trompeur, car des formes tardives de la plupart des
myopathies on été décrites. Néanmoins, on évoque en priorité,
chez le nouveau-né ou le nourrisson, une dystrophie congéni-
tale, une myopathie myotubulaire ou une forme néonatale de
maladie de Steinert et, devant un retard à la marche, une myo-
pathie congénitale ou métabolique. Chez le jeune enfant qui
vient d’acquérir la marche, la dystrophie musculaire de
Duchenne chez le garçon et les sarcoglycanopathies dans les
deux sexes sont les diagnostics les plus fréquents.
La topographie des anomalies musculaires, appréciée par
l’examen clinique ou aidée par l’examen électromyographique
et le scanner musculaire, est la seconde étape importante
d’orientation du diagnostic étiologique. Une hypertrophie des
mollets oriente en premier lieu vers une dystrophinopathie ou
une sarcoglycanopathie. L’étude attentive des muscles des
membres inférieurs montre une atteinte plus importante des
muscles pelviens que des muscles fémoraux dans les sarcogly-
canopathies. Un respect des abducteurs de cuisse associé à une
atrophie musculaire précoce et à des rétractions musculaires dis-
tales (plus rarement axiales) donne aux patients porteurs d’un
déficit en calpaïne une démarche caractéristique. Une atteinte
Attitude diagnostique devant un déficit
de la ceinture pelvienne
● C. Tranchant*
* CHRU de Strasbourg.

PATHOLOGIE MUSCULAIRE
La Lettre du Neurologue - Hors-série - avril 2002
6
précoce des muscles de la loge postérieure de cuisse et de jambe
ou la notion d’antécédents familiaux de myopathie distale des
membres inférieurs orientent vers une mutation du gène de la
dysferline, qui peut se traduire soit par une myopathie proxi-
male, soit par une myopathie distale de type Myoshi. Une
atteinte précoce de la ceinture scapulaire avec décollement des
omoplates n’est exceptionnelle ni dans les sarcoglycanopathies,
ni dans les déficits en calpaïne. L’atteinte des muscles laryngés
est rarement signalée, sauf dans les déficits en myotiline.
Une atteinte cardiaque précoce doit faire rechercher en priorité
un déficit en lamine (troubles de la conduction) ou certaines gly-
cogénoses (type II).
Les signes cliniques associés, lorsqu’ils existent, sont d’un grand
intérêt. Une myotonie conduit au diagnostic de PROMM, myopa-
thie myotonique proximale débutant à l’âge adulte aux membres
inférieurs et associée à une cataracte. Des myalgies au repos évo-
quent une myopathie inflammatoire ou iatrogène, mais ont été
décrites dans la PROMM. Des myalgies d’effort sont classiques
dans certaines myopathies métaboliques et au cours des déficits en
cavéoline 3. Les rétractions musculaires précoces sont caracté-
ristiques des myopathies ou des dystrophies musculaires congéni-
tales, mais sont fréquentes au cours des déficits en calpaïne (rétrac-
tions du triceps sural et de la musculature spinale) et dans certains
déficits en lamine, dont le tableau clinique est parfois très proche
de celui de la dystrophie musculaire d’Emery-Dreifuss (rétractions
musculaires et troubles de la conduction cardiaque). Chez l’enfant,
une atteinte des fonctions supérieures oriente plutôt vers une
dystrophinopathie que vers une sarcoglycanopathie. Une atteinte
associée du système nerveux central est présente dans certaines
dystrophies musculaires congénitales.
Diagnostic Trans- Protéine (PM) Gène Locus Début Clinique CPK
mission
Myopathie de Duchenne X Dystrophine Xp21.2 DMD < 10 ans – hypertrophie des mollets ±
Myopathie de Becker (427 kDa) BMD > 10 ans – perte précoce de la marche dans DMD
–atteinte cardiaque
α-sarcoglycanopathie AR α-sarcoglycane 17q12 LGMD2D < 10 ans – hypertrophie des mollets +
(50 kDa) – atteinte prédominante sur muscles pelviens
ß-sarcoglycanopathie AR ß-sarcoglycane 4q12 LGMD2E – atteinte scapulaire précoce associée
(43 kDa)
γ-sarcoglycanopathie AR γ-sarcoglycane 13q12 LGMD2C – l’α-sarcoglycanopathie est la plus fréquente
(35 kDa)
δ-sarcoglycanopathie AR δ-sarcoglycane 5q33 LGMD2F – la γ-sarcoglycanopathie est plus fréquente dans
(35 kDa) le Maghreb et dans les familles tziganes
Dysferlinopathie AR Dysferline 2p13 LGMD2B 15-20 – atteinte prédominante sur muscles postérieurs +++
(230 kDa) ans de cuisse
–atteinte distale (loge postérieure de jambe) clinique
ou infraclinique souvent associée
Calpaïnopathie AR Calpaïne 3 15q15 LGMD2A 2-40 ans – respect des abducteurs de cuisse ++
(94 kDa) (8-15) – atteinte scapulaire précoce
–rétractions tendons d’Achille
–absence d’atteinte cardiaque
Téléthoninopathie AR Téléthonine 17p11 LGMD2G 9-15 – atrophie ou hypertrophie des mollets +
(22 kDa) ans – atteinte cardiaque non exceptionnelle
–l’atteinte distale peut être prédominante
Déficit en myotiline AD Myotiline 5q22 LGMD1A 18-35 – voix nasonnée et dysarthrique ±
(57 kDa) ans
Déficit en lamine AD Lamine 1q11 LGMD1B 4-38 – troubles de la conduction cardiaque ±
ans – contractures musculaires inconstantes
Cavéolinopathie AD Cavéoline 3 3p25 LGMD1C < 10 – hyper trophie des mollets +
ans – myalgies d’effort
Dystrophie congénitale AR Mérosine 6q2 LAMA2 < 1 an – déficit musculaire généralisé, retard à la marche ++
mérosine-négative –contractures impor tantes
–hypersignaux T2 à l’IRM
Tableau. Dystrophies musculaires avec déficit moteur pelvien prédominant.

La Lettre du Neurologue - Hors-série - avril 2002 7
Le dosage des enzymes musculaires, et tout particulièrement
des phosphocréatine-kinases (CPK), peut lui aussi constituer un
élément d’orientation. Dans les dystrophies musculaires, les
taux les plus élevés sont décrits dans les déficits en dysferline
(parfois supérieurs à 100 fois la normale), puis dans les déficits
en calpaïne ou cavéoline ; un taux presque normal n’est pas
exceptionnel dans les sarcoglycanopathies.
L’étude génétique réalisée d’emblée à partir d’un prélèvement
sanguin est rarement informative. Elle ne se justifie que dans un
contexte familial très évocateur, comme cela est parfois le cas
dans les dystrophinopathies. Cependant, elle ne permet de
détecter que les grandes délétions ou les duplications du gène de
la dystrophine et n’est positive que dans 60 % des DMD et 10 %
des BMD.
La biopsie musculaire reste l’étape essentielle du diagnostic
étiologique dans la majorité des cas.
L’aspect histologique permet de distinguer les myopathies
congénitales (anomalies spécifiques), les dystrophies muscu-
laires (lésions de nécrose et de régénération), les myopathies
métaboliques (lésions de surcharge) et les myosites à inclusions
(vacuoles, etc.).
Le marquage immuno-histochimique est une étape essentielle
du diagnostic des dystrophies musculaires. La plupart des labo-
ratoires d’anatomie pathologique ne disposent que d’anticorps
antidystrophine, antisarcoglycanes et antimérosine. Ces immu-
nomarquages doivent être interprétés avec précaution.
Classiquement, on note, avec les anticorps antidystrophine, une
absence d’immunomarquage dans la DMD et un marquage irré-
gulier dans la BMD. La dystrophine étant une protéine d’an-
crage des autres protéines sarcolemniques, son immunomar-
quage peut également être altéré dans les sarcoglycanopathies.
Une étude immunohistochimique des sarcoglycanes doit donc
toujours être couplée à l’étude de la dystrophine. Son interpré-
tation est elle aussi délicate : en particulier, les déficits en β- et
α-sarcoglycanes s’accompagnent d’une absence totale d’immuno-
marquage des quatre sarcoglycanes.
La technique du Western-Blot permet, par électrophorèse puis
transfert sur une membrane, d’étudier les différentes protéines
musculaires, caractérisées par leur poids moléculaire et leur
immunomarquage. La technique du Western-Blot multiplex per-
met d’étudier simultanément les différentes protéines. Le Wes-
tern-Blot est essentiel pour confirmer ou affiner les résultats de
l’étude immunohistochimique. Il distingue la DMD (absence de
dystrophine) de la BMD (dystrophine anormale ou diminuée) et
des sarcoglycanopathies. Le diagnostic précis des sarcoglycano-
pathies doit prendre en compte le fait qu’une diminution de l’un
des composants du complexe des sarcoglycanes, qui ne peut se
former que lors de la synthèse des quatre protéines, s’accom-
pagne en général d’un déficit secondaire des trois autres. Ainsi,
l’α-sarcoglycane est diminuée dans toutes les sarcoglycanopa-
thies, et il y a un effondrement des quatre sarcoglycanes au
cours des ß- et -sarcoglycanopathies. Si toutes ces protéines
sont normales, on réalise en seconde intention (à moins d’un
tableau d’emblée très évocateur) :
–dans les formes récessives, une étude de la calpaïne, de la dys-
ferline ou de la téléthonine ;
–dans les formes dominantes, une étude de la cavéoline, de la
lamine ou de la myotiline.
Un déficit en calpaïne peut être secondaire à un déficit en dys-
ferline, et les deux protéines doivent toujours être comparées.
Le diagnostic de certitude repose sur la mise en évidence de
l’anomalie génétique. Même dans les formes classiques de dys-
trophie de Duchenne diagnostiquées dès l’étude immunohisto-
chimique, cette étape est indispensable dans la perspective d’un
conseil génétique, d’un diagnostic prénatal ou de la mise en évi-
dence des femmes vectrices. En raison de la multiplicité des
gènes impliqués dans les dystrophies musculaires en particulier,
et, pour chaque gène, de la multiplicité des mutations, ce dia-
gnostic génétique n’est possible que s’il est orienté par la
démarche clinique et anatomopathologique. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
❒Bornemann A, Goebel HH. Congenital myopathies. Brain Pathol 2001 ; 11 :
206-17.
❒Brown SC, Muntoni F, Sewry CA. Non-sarcolemmal muscular dystrophies.
Brain Pathol 2001 ; 11 : 193-205.
❒Bushby K. Making sense of the limb-girdle muscular dystrophies. Brain 1999 ;
122 : 1403-20.
❒Cohn RD, Campbell KP. Molecular basis of muscular dystrophies. Muscle
Nerve 2000 ; 23 : 1456-71.
❒Mastaglia FL, Laing NG. Investigation of muscle disease. J Neurol Neurosurg
Psychiatry 1996 ; 60 (3) : 256-74.
❒Ozawa E, Nishino I, Nonaka I. Sarcolemmopathy : muscular dystrophies with
cell membrane defects. Brain Pathol 2001 ; 11 : 218-30.
❒Ricker K, Koch MC, Lehmann-Horn F et al. Proximal myotonic myopathy : a
new dominant disorder with myotonia, muscle weakness, and cataracts.
Neurology 1994 ; 44 : 1448-52.
❒Ricker K, Grimm T, Koch MC et al. Linkage of proximal myotonic myopathy to
chromosome 3q. Neurology 1999 ; 52 : 170-1.
1
/
3
100%