Communiqué de presse - MSD Belgium Authoring

Communiqué de presse
____________________________________________________________________________________
Contacts avec les
médias :
Nilsy Desaint
Policy and
Communication Manager,
MSD
nilsy.desaint@merck.com
GSM : 0473 33 4875
De nouveaux résultats montrent une activité anti-tumeur durable avec le
Pembrolizumab, le traitement anti-PD-1 de MSD chez les patients atteints d’un
cancer avancé de la tête et du cou, quel que soit le statut d’expression de PD-L1
Résultats de KEYNOTE-012, la première et la plus grande étude jusqu’à ce jour sur un
traitement anti-PD-1 dans le cancer de la tête et du cou, qui seront présentés au congrès
annuel 2015 de l’ASCO
La monothérapie par pembrolizumab a permis d’obtenir un taux de réponse globale de
25 pour cent chez les patients lourdement traités précédemment
MSD développe un vaste programme clinique sur le pembrolizumab dans le cancer de la
tête et du cou avec cinq essais cliniques portant sur plusieurs lignes de traitement et en
association avec d’autres agents
Bruxelles, 3 Juin 2015 – MSD, connu sous le nom de Merck aux États-Unis et au Canada, a
annoncé de nouvelles données expérimentales évaluant le pembrolizumab, le traitement anti-
PD-1 du laboratoire, en tant que monothérapie de l’étude de phase 1b KEYNOTE-012 chez 132
patients précédemment traités, avec un cancer récurrent ou métastatique de la tête et du cou,
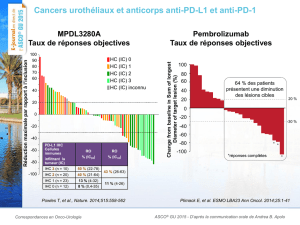
quel que soit le statut d’expression de PD-L1. Chez les patients évaluables, le taux de réponse
globale (TRO) (confirmé et non confirmé) était de 24,8 pour cent pour le pembrolizumab (dose
fixe de 200 mg toutes les trois semaines) (n=29/117) (IC à 95%, 17,3-33,6). En ce qui concerne
le statut HPV, le TRO était semblable pour les maladies HPV-positives et HPV-négatives (20,6
pour cent [n=7/34] et 27,2 pour cent [n=22/81], respectivement) (IC à 95%, 8,7-37,9 et 17,9-
38,2). Ces données, présentées dans le programme de presse d’ASCO, ont été présentées lors
d’une communication orale du Dr Tanguy Seiwert, de l’Université de Chicago, lundi 1er juin au
51ème Congrès annuel de l’ASCO (American Society of Clinical Oncology) à Chicago (Abstract
#LBA6008).
MSD a démarré un vaste programme de développement clinique sur le pembrolizumab
évaluant un traitement à dose fixe (200 mg toutes les trois semaines) dans le cancer de la tête

- 2 -
et du cou pour plusieurs lignes de traitement en monothérapie et en association avec des
chimiothérapies et d’autres agents. Les résultats de KEYNOTE-012 ont tout d’abord été
présentés au congrès annuel 2014 de l’ASCO et ont montré 19,6 pour cent de TRO pour le
pembrolizumab (10 mg/kg toutes les deux semaines) chez des patients lourdement traités
précédemment, avec un cancer avancé de la tête et du cou et des cellules tumorales positives
en termes d’expression de PD-L1.
"Le cancer avancé de la tête et du cou est une maladie grave et déterminante dans la
vie d’une personne. Malheureusement, il y a peu d’options de traitement efficaces,
particulièrement pour les patients dont la maladie ne répond pas aux traitements actuels", a
déclaré le Dr Seiwert. “En tant que clinicien oncologue, je suis très encouragé par les réponses
durables que le pembrolizumab a permis d’obtenir dans cette étude et j’attends avec impatience
les données qui seront présentées à l’avenir à partir d’études de confirmation additionnelles
actuellement menées sur le cancer avancé de la tête et du cou."
“La totalité des données présentées au congrès de l’ASCO complète nos connaissances
sur le potentiel clinique du pembrolizumab dans le cancer de la tête et du cou, quel que soit le
statut d’expression de PD-L1 ou de HPV”, a déclaré le Dr Roger Dansey, premier vice président
et chef du domaine thérapeutique, développement en oncologie de phase avancée, Merck
Research Laboratories. “Sur la base des résultats observés jusqu’à présent, nous développons
plusieurs études registres sur le cancer de la tête et du cou, y compris des évaluations
randomisées de survie globale et de survie sans progression avec le pembrolizumab, en
monothérapie et en association avec une chimiothérapie, par rapport aux soins standard.”
Résultats supplémentaires de KEYNOTE-012 sur le cancer avancé de la tête et du cou.
Des résultats supplémentaires de KEYNOTE-012, la première et la plus grande étude
de phase 1b sur un traitement anti-PD-1 dans le cancer avancé de la tête et du cou, a montré
une réduction de la tumeur chez 56 pour cent de tous les patients évaluables avec une maladie
mesurable par un scanner post-référence (n=59/106). La durée médiane de la réponse n’a pas
été atteinte (7,3+ - 25,1+ semaines parmi les patients avec une réponse confirmée), avec une
durée médiane de suivi de 5,7 mois (0,2 – 8,7 mois). Au moment de l’analyse, 86 pour cent des
patients ayant répondu ont continué à répondre au traitement (n=25/29). Les données sont
basées sur une analyse menée jusqu’à la date limite du 23 mars 2015.
Les événements indésirables de l’étude étaient généralement cohérents avec les
données de sécurité rapportées précédemment pour le pembrolizumab (n=132). Les
événements indésirables liés au traitement les plus courants (survenant chez au moins 5% des

- 3 -
patients) comprenaient : fatigue (15,2%), hypothyroïdie (9,1%), baisse de l’appétit (7,6%),
éruption cutanée (7,6%), sécheresse cutanée (6,8%), et pyrexie (6,8%). Certains patients ont
ressentis des événements indésirables présentant un intérêt particulier, dont : hypothyroïdie
(10,6%), pneumonite (3,0%), thyroïdite (2,3%), colite (0,8%), maladie pulmonaire interstitielle
(0,8%), épidermolyse bulleuse acquise (0,8%), lésions hépatiques induites par des
médicaments (0,8%), épidermolyse (0,8%) et acidocétose diabétique (0,8%). Quatre patients
ont ressentis des événements indésirables d’intérêt particulier ayant entraîné l’arrêt du
traitement. Il n’y a eu aucun décès lié au traitement.
L’étude KEYNOTE-012
KEYNOTE-012 est une étude multicentrique randomisée de phase 1b menée
actuellement pour évaluer la sécurité, la tolérabilité et l’activité antitumorale de la monothérapie
par pembrolizumab (10 mg/kg toutes les deux semaines ou 200 mg IV toutes les trois
semaines) chez des patients atteints d’un cancer du sein avancé triple négatif (CSTN), d’un
cancer de la tête et du cou, d’un carcinome urothélial avancé ou d’un cancer gastrique avancé.
Les critères d’évaluation principaux de l’étude comprennent la sécurité globale, la tolérabilité et
l’activité antitumorale (mesurées par RECIST v1.1) ; les critères d’évaluation secondaires
comprennent la survie sans progression (SSP), la survie globale (SG) et la durée de la réponse.
Le cancer de la tête et du cou
Le cancer de la tête et du cou décrit plusieurs tumeurs différentes qui se développent au
sein et autour de la gorge, du larynx, du nez, des sinus et de la bouche. La plupart des cancers
de la tête et du nez sont des carcinomes à cellules squameuses qui se développent dans les
cellules squameuses et plates qui constituent la fine couche de surface des structures de la tête
et du cou. Les principaux facteurs de risque modifiables liés au cancer de la tête et du cou
comprennent le tabac et la consommation importante d’alcool. D’autres facteurs de risque non
modifiables comprennent les infections par certains types de VPH, également appelés virus du
papillome humain. Chaque année, environ 400 000 cas de cancer de la cavité buccale et du
pharynx et environ 160 000 cancers du larynx, entraînent la mort de 300 000 personnes.
À propos du pembrolizumab
Le pembrolizumab est un anticorps monoclonal humanisé qui bloque l’interaction entre

- 4 -
PD-1 et ses ligands, PD-L1 et PD-L2. En se liant au récepteur de PD-1 et en bloquant
l’interaction avec les ligands du récepteur, le pembrolizumab lève l’inhibition de la réponse
immunitaire médiée par la voie du PD-1, et notamment la réponse immunitaire antitumorale.
MSD mène un programme de développement clinique d’envergure et à croissance
rapide pour le KEYTRUDA. En effet, ce programme comprend plus de 100 essais cliniques,
concernant plus de 30 types de tumeurs et plus de 16 000 patients, en monothérapie et en
association avec d’autres thérapies.
Notre intérêt pour le cancer
Notre objectif est de traduire les percées scientifiques en médicaments oncologiques
innovants pour aider les personnes atteintes de cancer dans le monde entier. Chez MSD
Oncologie, aider à lutter contre le cancer est une passion et nous nous engageons à favoriser
l’accès à nos médicaments contre le cancer. Notre priorité est de poursuivre la recherche en
immuno-oncologie et nous mettons tout en oeuvre pour accélérer le processus, du laboratoire à
la clinique, pour offrir un nouvel espoir aux personnes atteintes d’un cancer.
À propos de MSD
MSD est un leader mondial dans le domaine de la santé qui propose des médicaments,
des vaccins, des thérapies biologiques ainsi que des produits vétérinaires innovants afin de
promouvoir la santé et le bien-être des hommes et des animaux. Nous collaborons avec nos
clients dans plus de 140 pays afin de donner aux patients l’accès aux meilleures solutions de
santé.
Notre société est dénommée Merck aux États-Unis et au Canada et MSD dans les autres pays.
En Belgique et au Grand-Duché du Luxembourg, MSD fait partie des acteurs les plus
importants de l’innovation médicale. Nous y déployons une palette très large d’activités : la
recherche, la production et la commercialisation.
Pour plus d’informations, visitez www.msd-belgium.be ou www.msd.com.
Déclarations prospectives
Ce communiqué de presse contient des « déclarations prospectives » (forward looking
statements) au sens des dispositions libératoires de la loi américaine de 1995 intitulée « Private
Securities Litigation Reform Act ». Ces déclarations sont fondées sur les convictions et les
prévisions actuelles de la direction de MSD et sont exposées à de nombreux risques et

- 5 -
incertitudes. Rien ne garantit que les produits en cours de développement recevront les
approbations réglementaires nécessaires ou qu’ils auront un succès commercial. Si les
hypothèses sous-jacentes se révélaient inexactes, ou si certains risques ou incertitudes
venaient à se matérialiser, les résultats effectifs pourraient sensiblement varier par rapport à
ceux formulés dans les déclarations prospectives.
Ces risques et incertitudes comprennent, sans s’y limiter, les conditions générales du
secteur et la concurrence ; les facteurs économiques généraux, notamment les fluctuations des
taux d’intérêt et des taux de change ; l’effet des réglementations de l’industrie pharmaceutique
et de la législation en matière de soins de santé aux États-Unis et au niveau international ; les
tendances mondiales concernant la maîtrise des coûts de soins de santé ; les avancées
technologiques, les nouveaux produits et les brevets des concurrents ; les défis inhérents au
développement de tout nouveau produit, notamment l’obtention de l’approbation réglementaire ;
la capacité de MSD à prédire précisément les conditions futures du marché ; les difficultés ou les
retards de production ; l’instabilité financière des économies internationales et le risque
souverain ; la dépendance à l’égard de l’efficacité des brevets de Merck et des autres
protections relatives aux produits innovants ; ainsi que le risque de litiges, notamment les litiges
relatifs aux brevets, et/ou de mesures réglementaires.
MSD n’est aucunement tenue de publier des mises à jour de ses déclarations
prospectives en cas de nouveaux renseignements, d’événements futurs ou pour tout autre
motif. D’autres facteurs susceptibles de générer une différence notable entre les résultats réels
et ceux décrits dans les déclarations prospectives figurent dans le Rapport annuel 2014 de
MSD/Merck, sur le formulaire 10-K et dans les autres rapports déposés par la société auprès de
la Securities and Exchange Commission (SEC), qui peuvent être consultés sur le site Internet
de la SEC (www.sec.gov).
1
/
5
100%