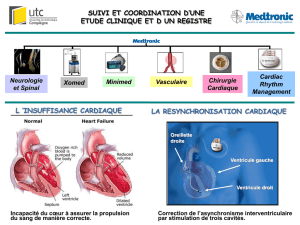
P Non-réponse à la resynchronisation cardiaque : que peut-on faire ?

MISE AU POINT
Figure 1. L’asynchronisme intraventriculaire est temporel et spatial. Les pics de contraction de certains segments
myocardiques surviennent après la fermeture de la valve aortique (premier trait vertical blanc) et même après
l’ouverture de la valve mitrale (second trait vertical blanc). Ces pics ne sont de plus pas synchrones.
La Lettre du Cardiologue • n° 466-467 - juin-septembre 2013 | 21
Non-réponse
à la resynchronisation
cardiaque : que peut-on faire ?
Non-response to CRT: what can we do?
G. Moubarak*, G. Vedrenne*, S. Cazeau*
* Département de rythmologie,
hôpital Saint-Joseph, Paris.
P
lus de 10 ans après la publication de la première
étude randomisée de la resynchronisation dans
l’insuffisance cardiaque, MUltisite STimulation
In Cardiomyopathy (MUSTIC) [1], le développement
de cette technique se heurte toujours à la barrière
des non-répondeurs, estimés à 30 % des patients
implantés, quel que soit le critère utilisé pour juger
de la réponse (remodelage échographique, amélio-
ration fonctionnelle, réduction de la morbimorta-
lité). Dans cette mise au point, nous aborderons
les différentes possibilités actuelles et futures qui
s’offrent au rythmologue interventionnel pour opti-
miser le résultat de l’implantation, ainsi que le rôle
du cardiologue traitant dans la prise en charge du
patient non-répondeur.
Objectif de la resynchronisation
Cela tombe sous le sens, mais c’est aujourd’hui large-
ment occulté : la resynchronisation vise à corriger
une désynchronisation. Cette désynchronisation est
mécanique, bien qu’appréciée presque exclusivement
par sa composante électrique ventriculaire repré-
sentée par la largeur du QRS. La désynchronisation
mécanique a 3 composantes, auriculoventriculaire,

Figure 2. Correction de l’asynchronisme intraventriculaire. La contraction de tous les segments myocardiques est
simultanée et en systole.
22 | La Lettre du Cardiologue • n° 466-467 - juin-septembre 2013
Points forts
»
L’évaluation de la désynchronisation mécanique par l’échographie est certainement utile dans la sélection
des patients, même si la largeur des QRS et leur morphologie sont encore les seuls critères actuellement
retenus.
»
Au cours d’une implantation classique, la position anatomique recherchée de la sonde VG est la portion
non apicale d’une veine latérale ou postérolatérale, à distance de la sonde VD. La placer en regard dela paroi
se contractant le plus tard semble être associé à de meilleurs résultats.
»
Il faut s’assurer que la resynchronisation est bien délivrée en permanence, notamment dans le cas
delafibrillation atriale.
»
Chez le patient non répondeur, des solutions techniques existent : stimulation multisite multipolaire
ou endocardique.
Mots-clés
Resynchronisation
cardiaque
Sélection des patients
Non-répondeurs
Techniques
destimulation
alternatives
Highlights
»
Assessment of dyssyn-
chrony by echocardiography is
certainly useful during patient
selection, even if QRS width
and morphology are the sole
criteria currently endorsed.
»
During standard implanta-
tion procedure, the LV lead
should be positionned non-
apically in a lateral or postero-
lateral vein, distant to the RV
lead. Positioning the LV lead
at the site with maximum
mechanical delay yields better
results.
»
The permanent delivery of
resynchronization must be
checked, particularly in patients
with atrial fibrillation.
»
Technical solutions exist
for non-responders: multisite,
multipolar or endocardial
pacing.
Keywords
Cardiac resynchronization
therapy
Patient selection
Non-responders
Alternative pacing techniques
interventriculaire et intraventriculaire gauche (2).
L’asynchronisme intraventriculaire est temporel (un
ou plusieurs segments myocardiques se contractant
au mauvais moment, c’est-à-dire trop tard, parfois
même après la fermeture de la valve aortique),
avec souvent une dimension spatiale si les diffé-
rents segments myocardiques ne se contractent
pas simultanément (figure 1, p. 21). La désynchro-
nisation intraventriculaire spatiale est la seule à être
parfois évaluée en routine.

MISE AU POINT
La Lettre du Cardiologue • n° 466-467 - juin-septembre 2013 | 23
L’objectif de la resynchronisation intraventriculaire
serait donc de faire se contracter des segments
myocardiques au bon moment, en systole (correc-
tion de l’asynchronisme temporel) et, si possible, en
même temps (correction de l’asynchronisme spatial)
[figure 2]. Une fois l’appareil implanté, les différents
points de stimulation appliqués doivent permettre
de raccourcir au minimum le temps d’activation
global du ventricule gauche.
Avant l’implantation : sélection
des patients candidats
à la resynchronisation
La première étape pour espérer obtenir une réponse
positive à la resynchronisation est donc de sélec-
tionner un patient :
➤
qui présente un certain degré de désynchroni-
sation ;
➤
dont la désynchronisation puisse bien être
corrigée par l’implantation de l’appareil.
Actuellement, le seul critère de désynchronisa-
tion retenu par les recommandations des sociétés
savantes est celui de la largeur des QRS (≥ 120 ms).
Cette approche simpliste est forcément imparfaite.
On peut en effet remarquer que, parmi l’ensemble
des patients avec un QRS ≥ 120 ms, la réponse la
plus nette est observée chez ceux qui ont des QRS
de plus de 150 ms. Mais tous les patients avec un
QRS > 150 ms ne sont pas des répondeurs et, à
l’inverse, tous les patients avec un QRS compris
entre 120 et 150 ms ne sont pas non plus implantés
pour rien. Dans l’étude DESIRE (3), 70 % des patients
avec un QRS relativement fin, compris entre 120 et
150 ms, et un critère d’asynchronisme mécanique
démontré par l’échographie étaient cliniquement
répondeurs à la resynchronisation. Enfin, tous les
QRS larges ne sont pas identiques : les patients ayant
un aspect de bloc de branche droit ou un trouble
indéterminé de la conduction intraventriculaire sont
moins souvent répondeurs que les patients avec un
bloc de branche gauche classique. Leur désynchro-
nisation est différente et n’est pas facile à corriger
avec nos moyens actuels. Les recommandations
européennes de 2012 sur l’insuffisance cardiaque (4)
ont intégré cette notion et exigent dorénavant que
les patients avec un bloc de branche droit ou un
trouble indéterminé de la conduction intraventri-
culaire aient un QRS ≥ 150 ms pour se voir proposer
une resynchronisation (contre toujours 120 ms pour
les patients avec bloc de branche gauche).
L’échographie cardiaque peut (doit ?) certaine-
ment jouer un rôle important dans la sélection
des patients, en sus de la largeur des QRS et de
leur morphologie. L’étude PROSPECT (Providing
Regional Observation to Study Prediction of Events in
the Coronary Trec) [5] avait déçu les espoirs placés
dans l’échographie, mais ses limites méthodolo-
giques (notamment la reproductibilité de la mesure
de certains paramètres) ont été très commentées
depuis. Pourtant, tout le monde a oublié que, dans
PROSPECT, certains paramètres simples, comme
le délai pré-éjectionnel gauche, le délai interven-
triculaire et la durée du remplissage diastolique,
étaient parfaitement reproductibles et prédisaient
significativement la réponse clinique et échogra-
phique.
En complément de cette première étape de screen ing
par l’ECG et l’échographie, il faudra considérer
certains éléments cliniques dans la décision d’im-
plantation d’une resynchronisation. Trois situations
en particulier inciteront à ne pas la proposer : la
dysfonction ventriculaire droite significative, l’exis-
tence d’une valvulopathie organique nécessitant une
correction chirurgicale et l’insuffisance cardiaque
terminale. L’évolution naturelle de ces patients est
de toute façon péjorative à court ou à moyen terme
et n’est pas modifiée par la resynchronisation dite
“de sauvetage”, qui est actuellement quasiment
abandonnée.
L’implantation d’un système
de resynchronisation classique :
comment l’optimiser ?
La mise en place d’une sonde atriale et d’une sonde
ventriculaire droite (de stimulation ou de défibril-
lation) ne pose en règle générale aucun problème.
La sonde ventriculaire gauche peut être plus déli-
cate à implanter dans une veine coronaire : il faut
qu’elle ait une position stable dans la veine, avec de
bons paramètres de fonctionnement (notamment
un seuil de stimulation acceptable), sans induire de
stimulation phrénique. Si cette approche purement
anatomique est maintenant couronnée de succès
dans 90 à 95 % des cas, elle ne garantit pas que la
stimulation biventriculaire ainsi délivrée permettra
de corriger la désynchronisation que présente le
malade.
On dispose de plusieurs “astuces” pour améliorer
le taux de réponse obtenu avec cette implantation
“classique”.

Non-réponse à la resynchronisation cardiaque : que peut-on faire ?
MISE AU POINT
24 | La Lettre du Cardiologue • n° 466-467 - juin-septembre 2013
Où placer “anatomiquement” les sondes
VG et VD ?
Il existe maintenant des données solides, notamment
des analyses des études MADIT-CRT (A Multicenter
Automatic Defibrillator Implantation Trial with Cardiac
Resynchronization Therapy) et REVERSE (REsynchroni-
zation reVErses Remodeling in Systolic left vEntricular
dysfunction) [6, 7], indiquant que la sonde VG ne
doit pas être placée dans une position apicale. L’effet
bénéfique de la position non apicale se traduit par un
remodelage échographique favorable plus fréquent,
et même une diminution de la morbimortalité. Cette
constatation est relativement logique si l’on consi-
dère que, dans le bloc de branche gauche (ce qui
concerne la majorité des patients implantés), l’apex
est activé précocement (au contraire de la paroi laté-
rale) : il est peut-être inutile de stimuler une paroi qui
n’est pas en retard… De plus, la stimulation apicale
ou para-apicale peut induire une séquence d’activa-
tion mécanique inversée par rapport à la séquence
d’activation mécanique naturelle, à point de départ
basal. L’autre explication est que 88 % des patients
de MADIT-CRT et 69 % des patients de REVERSE
avaient une sonde VD également apicale, soit anato-
miquement très proche de la sonde VG (stimula-
tion biventriculaire “monosite” ?). De nombreuses
données suggèrent qu’une grande distance anato-
mique entre les 2 électrodes est importante pour
optimiser la réponse à la resynchronisation (8). Là
encore, c’est logique : si on veut réduire le temps
d’activation global des ventricules, il vaut mieux
les stimuler à partir de points distants plutôt que
tout proches. Ainsi, la position de la sonde VD en
elle-même pourrait n’avoir que peu d’importance (il
n’a pas été montré de différence selon qu’elle soit
infundibulaire ou apicale) : c’est sa position relative
à la sonde VG qui compte.
Choix du site VG en fonction
de l’importance de l’asynchronisme
Quoi de plus logique que de placer la sonde VG
en regard de la paroi qui a le plus grand degré
de retard, si l’on ne raisonne qu’en termes de
désynchronisation intraventriculaire spatiale ?
La première approche est de retenir l’asynchro-
nisme électrique, estimé par le délai entre le début
du QRS et l’électrogramme local enregistré au
bout de la sonde (9). S’il a été montré que cette
approche est corrélée à une meilleure réponse
hémodynamique aiguë, elle n’est toutefois pas
facilement réalisable en pratique, car elle nécessi-
terait de déplacer la sonde VG dans plusieurs veines
(et à l’intérieur même des veines) pour recher-
cher le site qui s’active avec le plus de retard…
La seconde approche, plus prometteuse, serait
de se focaliser sur l’asynchronisme mécanique.
L’idée est d’implanter la sonde VG en regard de
la paroi qui se contracte en dernier, déterminée
grâce à une évaluation par l’échographie de strain
par exemple (10). Habituellement, il s’agit d’une
veine latérale ou postérolatérale. Si l’on arrive
bien à implanter la sonde en regard de la paroi
d’intérêt (site dit “concordant” avec les données
de l’échographie), le taux de réponse augmente
significativement, selon certains auteurs.
Choix du site VG en fonction
de la fibrose myocardique
Pour espérer une resynchronisation efficace, le
site “retardé” visé ne doit pas être “cicatriciel”,
comme c’est souvent le cas dans les cardiopa-
thies ischémiques. Il faut en effet que l’activation
électrique à partir de ce point puisse rapide-
ment diffuser à l’ensemble du myocarde ; or, la
conduction électrique à partir d’une stimulation
en regard de zones de fibrose transmurale (“scar”)
est malheureusement souvent très lente. Pendant
l’implantation, on peut le vérifier en surveillant la
durée d’activation des ventricules et la durée du
QRS. Le résultat de la resynchronisation sera alors
forcément décevant (11).
Après l’implantation
du système
de resynchronisation :
collaboration
entre le rythmologue
et le cardiologue traitant
Ce n’est pas parce que le rythmologue a terminé
son intervention que tout est réglé ! Il est nécessaire
qu’un dialogue s’instaure entre le centre implan-
teur (rythmologue, échographiste connaissant le
domaine) et le cardiologue traitant pour s’assurer
que :
➤
la resynchronisation est délivrée en permanence ;
➤le patient est bien resynchronisé ;
➤il en tire un bénéfice.

MISE AU POINT
La Lettre du Cardiologue • n° 466-467 - juin-septembre 2013 | 25
La resynchronisation est-elle bien
permanente ?
Pour que la resynchronisation marche, il faut déjà que la
stimulation soit délivrée tout le temps ! Trois situations
empêchent fréquemment une capture biventriculaire
permanente : un délai auriculoventriculaire trop long
chez les patients en rythme sinusal, l’existence d’une
FA (pas forcément rapide, d’ailleurs) et, chez tous les
patients (en rythme sinusal ou FA), des extrasystoles
ventriculaires (ESV) fréquentes.
Le premier cas peut être diagnostiqué sur un simple
ECG et nécessitera de raccourcir par programmation
le délai auriculoventriculaire. Dans le cas de la FA, le
bénéfice de la resynchronisation n’est obtenu que pour
des pourcentages de stimulation supérieurs à 95 % (12).
Ainsi, en l’absence d’une FA spontanément très lente,
sans intervalles RR courts, l’ablation de la jonction
auriculoventriculaire tend à devenir systématique. Les
ESV, quant à elles, doivent pousser à optimiser le trai-
tement médicamenteux. Une ablation peut se discuter,
surtout si les ESV sont nombreuses et monomorphes.
Le patient est-il bien resynchronisé ?
C’est là le rôle de l’échographie, qui doit déterminer si
la resynchronisation a bien corrigé la désynchronisation
initiale du patient ! On a vu plus haut que ce n’était
en effet pas automatique. La place de l’optimisation
régulière des réglages des délais auriculoventriculaire et
peut-être interventriculaire par l’échographie est encore
débattue. Si elle n’est pas forcément indispensable en
routine, n’ayant pas fait la preuve de son efficacité (13),
elle devient importante chez un patient non répondeur.
Le patient tire-t-il bénéfice
de la resynchronisation ?
La vérification du bon résultat électrique et méca-
nique de la resynchronisation ne doit pas faire oublier
la prise en charge globale du patient, au centre de
laquelle se trouve son cardiologue traitant. Combien
de patients croient à tort que l’appareil va tout régler
et qu’ils pourront se passer de leurs médicaments ? Au
contraire, une bonne resynchronisation est l’occasion
de renforcer le traitement médical, en augmentant les
doses de β-bloquant et d’IEC, si elles n’avaient pas pu
l’être auparavant. Enfin, il importe de rechercher et de
traiter les autres comorbidités, cardiovasculaires ou
non (ischémie myocardique, approche agressive des
arythmies, anémie, etc.), de surcroît en cas de non-
réponse initiale ou de dégradation secondaire de l’état
du patient. La resynchronisation est l’un des aspects
du traitement de la défaillance myocardique, mais non
le seul, et n’est – rappelons-le – qu’un traitement de
la désynchronisation et non de la maladie causale.
Que peut faire le rythmologue
en dehors de l’implantation
classique ?
Malheureusement, malgré toutes les précautions
détaillées ci-dessus, certains patients restent non
répondeurs à la resynchronisation “classique” (1 sonde
VD et 1 sonde VG placée dans une veine coronaire).
Des techniques nouvelles peuvent représenter une
alternative intéressante pour ces patients, toujours
dans le but de délivrer une resynchronisation de meil-
leure qualité. Une fois arrivées à maturité, il n’est pas
interdit de penser que certaines d’entre elles pourront
être proposées en première intention.
Mise en place de 3 sites de stimulation
(ou plus)
◆Trois sondes
Il peut s’agir de mettre 3 sondes : 2 sondes VD +
1 sonde VG (figure 3, p. 26), ou bien 1 sonde VD +
2 sondes VG. La première configuration est plus aisée
techniquement, consistant à implanter une sonde
VD apicale et l’autre en position infundibulaire. Une
équipe japonaise a montré qu’un tiers des patients
avaient une amélioration hémodynamique aiguë
en “tri-V” par rapport au “bi-V” (14). La deuxième
configuration, testée par des équipes françaises, est
techniquement réalisable dans 85 % des cas, avec une
amélioration échographique à 3 mois (15). Dans les
2 cas, il reste à démontrer un effet bénéfique sur la
morbimortalité (résultats de l’étude V3 en attente).
◆Sondes multipolaires
Les industriels proposent ou développent de
nouvelles sondes pouvant délivrer la stimulation à
partir de plusieurs pôles sur leur trajet, multipliant
ainsi les possibilités des sites de stimulation sans
multiplier le nombre des électrodes implantées (16).
Stimulation endocardique
Cette approche théoriquement séduisante permet
de stimuler le VG à partir de l’endocarde (et non plus
 6
6
1
/
6
100%