Lire l'article complet

* Service de chirurgie digestive, hôpital Lariboisière, Paris.
** Service de gastroentérologie et d’assistance nutritionnelle,
hôpital Lariboisière, Paris.
Traitement d’une colite aiguë grave compliquant
une maladie inflammatoire chronique de l’intestin
Treatment of acute colitis complications
inflammatory bowel disease
●A. Alves*, Y. Bouhnik**, Y. Panis*
L
a colite aiguë grave (CAG) peut mettre en jeu le pro-
nostic vital et nécessite une prise en charge urgente en
milieu hospitalier. Cette complication est observée dans
15 à 20 % des cas au cours des maladies inflammatoires chroniques
de l’intestin (MICI) (1, 2).
COMMENT FAIRE LE DIAGNOSTIC ?
En dehors des urgences chirurgicales représentées par l’hémorra-
gie grave, le mégacôlon toxique ou la perforation, le diagnostic de
CAG repose sur la mise en évidence de critères de gravité clinico-
biologiques et/ou morphologiques (1). Ces critères clinicobiolo-
giques comportent également des critères évolutifs englobant la
résistance au traitement par corticoïdes. Ils ont surtout été étudiés
dans la rectocolite hémorragique (RCH) (3).
Les critères clinicobiologiques
Les critères de Truelove et Witts (4) ont été établis de façon empi-
rique dans les années 1950 par l’équipe d’Oxford dans la recto-
colite hémorragique (tableau I). Le but était d’identifier, grâce à
quelques critères simples, les poussées sévères, dont la mortalité
était de 31 %. La mise en œuvre, dans ces formes, d’un traitement
médical intensif fondé sur les corticoïdes, suivi, en cas d’échec,
d’une intervention chirurgicale, a permis de faire chuter la mor-
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005 147
Sévérité de la poussée Sévère* Légère*
Nombre ≥6sanglantes 4
d’évacuations/jour peu sanglantes
Température vespérale ≥37,5 °C sur 4 jours absence
ou de fièvre
≥37,8 °C 2 jours sur 4
Fréquence cardiaque ≥90 bpm absence
de tachycardie
Taux d’hémoglobine < 75 % de la valeur absence
normale d’anémie
Vitesse de sédimentation ≥30 < 30
(1re heure)
* La poussée est dite modérée dans les situations intermédiaires.
Tableau I. Classification de la sévérité des poussées de RCH selon
Truelove et Witts (4).
POINTS FORTS
POINTS FORTS
■La colite aiguë grave (CAG) peut mettre en jeu le pro-
nostic vital et nécessite une prise en charge urgente en milieu
hospitalier.
■La coloscopie permet d’apprécier la gravité des lésions
muqueuses chez 4 malades sur 5.
■Les corticoïdes sont le traitement de première intention, par
voie parentérale, à la posologie de 1 mg/kg/j d’équivalent pred-
nisolone.
■En l’absence d’efficacité thérapeutique au bout de 5 à
7jours et en l’absence de complications (péritonite, méga-
côlon toxique, choc hémorragique) se discutent un traitement
par ciclosporine à la posologie de 2 mg/kg/j ou la colectomie
subtotale (CST), qui est l’intervention de référence permet-
tant d’enlever la quasi-totalité du côlon malade sans faire d’ana-
stomose afin de limiter les complications postopératoires.
■Le Rémicade®(infliximab) serait également une alterna-
tive thérapeutique en l’absence d’efficacité des corticoïdes.

DOSSIER THÉMATIQUE
talité à 3 % (4). À l’heure actuelle, la sensibilité de ce score seul
est insuffisante pour ne considérer comme CAG que les malades
ayant les cinq critères au complet (3). Ces critères, modifiés par
la même équipe d’Oxford, définissent une poussée sévère comme
l’association de l’un des critères de Truelove et Witts à au moins
un des quatre autres et à une albuminémie < 35 g/l (5).
Les critères de Travis ont permis de définir un score prédictif de
colectomie dans la RCH (6). Parmi 36 paramètres clinicobiolo-
giques et radiologiques étudiés chez 51 malades atteints de CAG,
la présence, au 3ejour du traitement médical, de l’un des deux cri-
tères suivants : > 8 selles glairosanglantes/24 heures ou 3 à 8 selles
glairosanglantes/24 heures et une CRP > 45 mg/l était prédictive
d’une colectomie dans 85 % des cas (6). Un nouveau score à par-
tir des critères de Lichtiger et al. (7) a été décrit chez des malades
ayant une RCH, traités par ciclosporine (tableau II). Les CAG
sont définies par un score > 12 ; la réponse au traitement est défi-
nie par un score < 10 et par une diminution ≥3points par rapport
au score initial.
Les critères morphologiques
L’abdomen sans préparation est utile pour rechercher un pneumo-
péritoine et une colectasie (le mégacôlon toxique associe une dila-
tation du côlon > 6 cm sur la radio et un tableau clinique grave
marqué par des signes de sepsis). Il est réalisé tous les jours pen-
dant le traitement d’attaque d’une CAG (1). La tomodensitométrie
est utile au diagnostic de pneumopéritoine quand une perforation
est suspectée et qu’un pneumopéritoine n’est pas décelé de manière
évidente par l’abdomen sans préparation (3).
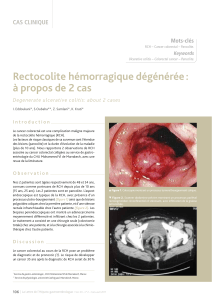
La coloscopie a été proposée pour apprécier directement la gravité
des lésions muqueuses (figure). Dans notre expérience (8),la fia-
bilité de la coloscopie pour la prédiction de la sévérité des lésions
était de 84 %, parmi 155 malades consécutifs atteints de CAG.
Le risque de complication de la
coloscopie entre des mains ex-
périmentées a été évalué à 4 %
(8, 9). Dans le cas de la recto-
colite hémorragique, une explo-
ration limitée au côlon gauche
suffit pour porter le diagnostic
de gravité dans 90 % des cas.
L’iléocoloscopie avec biopsies
étagées peut être utile pour pré-
ciser le type de MICI (particuliè-
rement en cas de poussée grave
révélatrice de la maladie) et
rechercher une surinfection à
cytomégalovirus (2).
Diagnostic différenciel
et formes intriquées
Toute colite aiguë peut se compliquer de CAG, qu’elle soit de cause
infectieuse, ischémique ou médicamenteuse. Le diagnostic diffé-
renciel est donc parfois difficile, en particulier quand la poussée
est inaugurale. Une surinfection à cytomégalovirus doit être recher-
chée en cas de résistance au traitement ou d’aggravation sous trai-
tement médical (10).
MOYENS THÉRAPEUTIQUES
Moyens médicaux
Les corticoïdes
L’efficacité de la corticothérapie est bien établie. Le schéma théra-
peutique universellement adopté (1 mg/kg/j d’équivalent predniso-
lone) a permis de faire passer la mortalité des poussées graves de
30 % dans les années 1950 à moins de 1 % dans les séries les plus
récentes (11).
Les antibiotiques
Leur utilisation est recommandée dans les situations suivantes :
doute avec une cause infectieuse et biopsies coliques en cas de
colectasie ou de fièvre élevée (3).
Le repos digestif
La mise au repos de l’intestin par le jeûne ou une diète stricte asso-
ciée à une perfusion périphérique fait partie du traitement médical
intraveineux intensif (3).
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005
148
Figure. Colite grave endoscopique.
Symptôme Score
Diarrhée (nombre de selles)
0-2 0
3-4 1
5-6 2
7-9 3
10 4
Diarrhée nocturne
non 0
oui 1
Sang dans les selles
00
<50% 1
>50% 2
100 % 3
Incontinence fécale
non 0
oui 1
Douleur abdominale
aucune 0
modérée 1
moyenne 2
sévère 3
État général
parfait 0
très bon 1
bon 2
moyen 3
mauvais 4
très altéré 5
Douleur à la palpation abdominale
aucune 0
modérée et localisée 1
modérée à moyenne diffuse 2
sévère ou douleur de rebond 3
Antidiarrhéiques
non 0
oui 1
Tableau II. Score de sévérité de la RCH selon Lichtiger (7).

Les immunomodulateurs
De nombreuses études ont rapporté l’efficacité de la ciclosporine
dans les colites aiguës graves et/ou corticorésistantes (12, 13).
Toutefois, elle a de nombreux effets indésirables potentiels. Récem-
ment, une étude contrôlée a montré que la ciclosporine était aussi
efficace à la dose de 2 mg/kg/j qu’à la dose de 4 mg/kg/j (14). La
posologie de 2 mg/kg/j par voie intraveineuse est désormais recom-
mandée (14). Plusieurs études ouvertes portant sur un petit nombre
de malades suggèrent que l’azathioprine orale permet de maintenir
à long terme la rémission obtenue à court terme par la ciclospo-
rine i.v. chez environ 50 % des malades (15).
Les moyens chirurgicaux
La colectomie subtotale (CST) est l’intervention de référence per-
mettant d’enlever la quasi-totalité du côlon malade sans faire
d’anastomose afin de limiter les complications postopératoires, en
particulier le risque de fistule anastomotique (1). Elle est indiquée
en cas de résistance au traitement médical ou d’emblée en cas de
complications (perforation, colectasie, hémorragie). La sigmoï-
dostomie est indiquée en raison du doute diagnostique sur la cause
exacte de la colite. Dans notre expérience (8),l’analyse anatomo-
pathologique de la pièce opératoire chez 164 malades consécutifs
a permis de modifier la nature de la maladie causale dans plus de
la moitié des cas (54 %). Ainsi, parmi 164 malades consécu-
tifs, le diagnostic définitif était une maladie de Crohn chez
110 malades, une RCH dans 35 cas et une colite indéterminée
dans 19 cas.
L’iléostomie et la sigmoïdostomie sont confectionnées habituelle-
ment dans deux orifices différents, le premier en fosse iliaque droite,
le second en bas de l’incision médiane. La fermeture du moignon
rectal dans la cavité péritonéale n’est pas recommandée en rai-
son de la fréquence élevée des abcès intra-abdominaux (16). Dans
notre expérience, l’iléosigmoïdostomie est confectionnée dans le
même orifice en fosse iliaque droite, permettant, d’une part, de
diminuer la fréquence des occlusions postopératoires et, d’autre
part, de permettre un rétablissement ultérieur de la continuité
digestive par voie élective, en fonction de la cause et de l’état du
rectum. Dès le lendemain de l’intervention, des lavements du moi-
gnon rectosigmoïdien à l’aide de sérum physiologique, de dérivés
salicylés et de corticoïdes sont réalisés, et ce pendant une durée
de 3 mois.
Si, dans le passé, la mortalité de la CST pour CAG variait de 7 à
44 %, notamment dans les formes compliquées (17-19),elle est
actuellement faible dans les centres expérimentés. Ainsi, dans
notre expérience, la mortalité opératoire était inférieure à 1 %,
alors que 25 % des malades avaient des formes compliquées
(hémorragie, perforation, colectasie). La morbidité postopératoire
était de 33 % (9). La principale complication était l’occlusion post-
opératoire (15 %), nécessitant une réintervention dans la moitié
des cas. Dans la littérature, l’occlusion sur bride représente la prin-
cipale complication postopératoire chirurgicale, dont la fréquence
varie entre 5 et 25 % des cas. Dans notre expérience, la morbidité
était comparable chez les patients opérés en urgence pour des formes
compliquées par rapport aux patients opérés en urgence relative
(38 % versus 32 %). La durée moyenne d’hospitalisation était de
13 jours.
Trois mois plus tard, un lavement aux hydrosolubles avec recto-
graphie de profil et une endoscopie sont réalisés afin de rechercher
un microrectum et une rectite. Selon l’étiologie, un rétablissement
par voie élective (anastomose iléorectale) ou une proctectomie
secondaire avec anastomose iléo-anale seront programmés. Dans
le cadre d’une RCH, Penna et al. ont rapporté que la réalisation
d’une CST suivie, dans un second temps, d’une AIA n’altère pas
les résultats fonctionnels et n’augmente pas la morbidité par rap-
port à une AIA réalisée en un temps (20).
La plus grande série publiée de CAG compliquant une RCH opérée
par voie laparoscopique d’une CST a porté sur 18 patients (21).
Dans cette étude prospective, la conversion était nulle, la morbidité
postopératoire était de 33 % et la durée opératoire moyenne était
d’environ 4 heures. Aucun patient ne nécessitait de réintervention
précoce. La durée moyenne d’hospitalisation était de 5 jours (contre
9jours par laparotomie, p < 0,05). Depuis lors, trois études rétro-
spectives comparatives (22-24) ont évalué la place de la laparo-
scopie dans les colites résistantes au traitement médical. La durée
opératoire était significativement plus longue après CST par laparo-
scopie, le taux de conversion variant de 0 à 8 %. Bien que non
significative, la morbidité globale était plus faible après CST par
laparoscopie (16-35 % versus 24-56 %). La durée moyenne d’hos-
pitalisation était significativement réduite après CST par laparo-
scopie (22-24). Ces études suggèrent que la CST par laparoscopie
est réalisable en cas de colites aiguës résistantes au traitement médi-
cal, avec des résultats comparables à ceux de la laparotomie, dans
des centres experts.
TRAITEMENT INITIAL DE PREMIÈRE LIGNE
Les corticoïdes sont le traitement de première intention de la
CAG, par voie intraveineuse, à la posologie recommandée de
1mg/kg/j d’équivalent prednisolone. Ils sont associés à la mise
au repos du tube digestif et à des antibiotiques. Cette cortico-
thérapie est maintenue jusqu’à l’obtention d’une réponse clinique
franche, sans dépasser 7 jours, si ce traitement n’est pas efficace.
En l’absence de réponse au traitement médical, une nouvelle
coloscopie est réalisée au 5ejour afin d’évaluer la gravité des
lésions.
TRAITEMENT INTENSIF DE DEUXIÈME LIGNE :
CICLOSPORINE OU CHIRURGIE
Ce traitement doit être envisagé en l’absence de réponse clinique
et biologique entre 3 et 5 jours après le début de la corticothérapie
intraveineuse.
–Les principaux arguments en faveur du traitement chirurgi-
cal d’emblée sont :
•les risques d’une intervention trop tardive (péritonite par perfo-
ration colique) ;
•les risques d’effets secondaires sévères et potentiellement irré-
versibles de la ciclosporine ;
•la fréquence des rechutes chez les malades traités par ciclospo-
rine (30 à 60 % des malades colectomisés).
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005 149

DOSSIER THÉMATIQUE
–Les arguments en faveur du traitement par la ciclosporine
sont :
•son efficacité remarquable et rapide ;
•les chances de maintenir une rémission par azathioprine ou
6-mercaptopurine.
La ciclosporine doit être débutée à la dose de 2 mg/kg/j par voie
intraveineuse pendant 8 jours.
Depuis l’étude de Travis et al. (6),il est conseillé de débuter le
traitement par la ciclosporine dès le 4ejour en l’absence de réponse
au traitement médical intensif initial de première ligne. Cependant,
en cas d’apparition de signes de gravité (rectorragies abondantes
responsables d’une anémie aiguë [Hb < 6 g/dl] et/ou nécessitant
des transfusions abondantes et/ou répétées, mégacôlon toxique
ou perforation colique), la CST sera réalisée en urgence.
–Place du Remicade®
Une étude prospective multicentrique randomisée (25) comparant
le Remicade®au placebo dans les colites aiguës sévères compli-
quant une RCH et résistant aux corticoïdes a récemment montré
que le Remicade®permettait de réduire significativement le recours
à une CST à 90 jours. Ainsi, parmi 45 patients inclus (24 dans le
groupe Remicade®et 21 dans le groupe placebo), l’administration
de Remicade®à la posologie de 5 mg/kg ramenait le recours à la
chirurgie de 67 % à 29 % (p = 0,017). Si la différence n’était pas
significative chez les patients ayant une CAG fulminante (69 % ver-
sus 47 %, NS), en revanche, aucun patient ayant une CAG modérée
n’a été opéré dans le groupe Remicade®,contre 63 % dans le groupe
placebo (p = 0,009). Cette étude suggère que le Remicade®est
une alternative thérapeutique chez des patients atteints d’une RCH,
en l’absence d’efficacité des corticoïdes.
CONCLUSION
La CAG complique 15 à 20 % des MICI et peut mettre en jeu le
pronostic vital. En dehors des urgences chirurgicales, le diagnostic
de CAG repose sur la mise en évidence de critères de gravité
clinicobiologiques et/ou morphologiques. Les corticoïdes sont le
traitement de première intention de la CAG, par voie intraveineuse,
à la posologie recommandée de 1 mg/kg/j d’équivalent predniso-
lone, associés à la mise au repos du tube digestif et à des anti-
biotiques. En l’absence d’efficacité au bout de 5 jours, et en l’ab-
sence de complications, la ciclosporine ainsi que, depuis peu, le
Remicade®représentent des alternatives thérapeutiques au traite-
ment chirurgical. La CST est l’intervention de référence permet-
tant d’enlever la quasi-totalité du côlon malade sans faire d’anasto-
mose afin de limiter les complications postopératoires, en
particulier le risque de fistule anastomotique. Elle est indiquée en
cas de résistance au traitement médical ou d’emblée en cas de
complications (perforation, colectasie, hémorragie). ■
Mots-clés : Colite aiguë grave - Corticoïdes - Ciclosporine -
Colectomie subtotale.
Keywords: Acute colitis – Steroids – Cyclosporin – Subtotal colec-
tomy.
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Katz JA. Medical and surgical management of severe colitis. Semin Gast Dis
2000;11:18-32.
2. Champault A, Benoist S, Alves A, Panis Y. Le traitement chirurgical des
atteintes coliques et rectales de la maladie de Crohn. Gastroenterol Clin Biol
2004;28:882-982.
3. Bouhnik Y, Alves A, Beau P et al. Traitement de la rectocolite ulcéro-hémor-
ragique dans sa forme grave. Gastroenterol Clin Biol 2004;28:984-91.
4. Truelove SC, Witts LJ. Cortisone in ulcerative colitis. Br Med J 1955;2:1041-8.
5. Chapman RW, Selby WS, Jewell DP. Controlled trial of intravenous metroni-
dazole as an adjunct to corticosteroids in severe ulcerative colitis. Gut 1986;27:
1210-2.
6. Travis SP, Farrant JM, Ricketts C et al. Predicting outcome in severe ulcerative
colitis. Gut 1996;38:905-10.
7. Lichtiger S, Present DH, Kornbluth A et al. Cyclosporin in sever ulcerative
colitis refractory to steroid therapy. N Engl J Med 1994;330:1841-5.
8. Alves A, Panis Y, Bouhnik Y et al. Subtotal colectomy for severe acute colitis:
a twenty-year experience of a tertiary care center with an aggressive and early
surgical policy. J Am Coll Surg 2003;197:379-85.
9. Carbonnel F, Lavergne A, Lemann M et al. Colonoscopy of acute colitis: a
safe and reliable assessment of severity. Dig Dis Sci 1994;39:1550-7.
10. Wada Y, Matsui T, Matake H et al. Intractable ulcerative colitis caused by
cytomegalovirus infection: a prospective study on prevalence, diagnosis, and
treatment. Dis Colon Rectum 2003;46:S59-S65.
11. Jarnerot G, Rolny P, Sandberg-Gertzen H. Intensive intravenous treatment
of ulcerative colitis. Gastroenterology 1985;89:1005-13.
12. Carbonnel F, Boruchowicz A, Duclos B et al. Intravenous cyclosporine in
attacks of ulcerative colitis: short-term and long-term responses. Dig Dis Sci
1996;41:2471-6.
13. D’Hæns G, Lemmens L, Geboes K et al. Intravenous cyclosporin versus
intravenous corticosteroids as single therapy for severe attacks of ulcerative
colitis. Gastroenterology 2001;120:1323-9.
14. Van Assche G, D’Hæns G, Noman M et al. Randomized double-blind compa-
rison of 4mg/kg versus 2mg/kg intravenous cyclosporine in severe ulcerative
colitis. Gastroenterology 2003;125:1025-31.
15. Actis GC, Bresso F, Astegiano M et al. Safety and efficacy of azathioprine
in the maintenance of cyclosporin-induced remission of ulcerative colitis. Aliment
Pharmacol Ther 2001;15:1307-11.
16. Carter FM, McLeods RS, Cohen Z. Subtotal colectomy for ulcerative colitis:
complications related to rectal remnant. Dis Colon Rectum 1991;34:1005-9.
17. Mikkola KA, Järvinen HJ. Management of fulminating ulcerative colitis. Ann
Chir Gyn 1992;81:37-41.
18. Hawley PR. Emergency surgery for ulcerative colitis. World J Surg 1988;
12:169-73.
19. Harms BA, Myers GA, Rosenfeld DJ, Starling JR. Management of fulminant
ulcerative colitis by primary restorative colectomy. Dis Colon Rectum 1994;37:
971-8.
20. Penna C, Daude F, Parc R et al. Previous subtotal colectomy with ileosto-
my and sigmoidostomy improves the morbidity and early functional results after
ileal pouch-anal anastomosis in ulcerative colitis. Dis Colon Rectum 1993;
36:343-8.
21. Bell RL, Seymour NE. Laparoscopic treatment of fulminant ulcerative colitis.
Surg Endosc 2002;16:1778-82.
22. Seshadri PA, Poulin EC, Schlachta CM et al. Does a laparoscopic approach
to total abdominal colectomy and proctocolectomy offer advantages? Surg Endosc
2001;15:837-42.
23. Dunker MS, Bemelman WA, Slors JFM et al. Laparoscopic-assisted vs open
colectomy for severe acute colitis in patients with inflammatory bowel disease
(IBD). A retrospective study in 42 patients. Surg Endosc 2000;14:911-4.
24. Marcello PW, Milsom JE, Wong SK et al. Laparoscopic total colectomy for
acute colitis. A case-control study. Dis Colon Rectum 2001;44:1441-5.
25. Jarnerot G, Hertervig E, Friis-Liby I et al. Infliximab as rescue therapy in
severe to moderately severe ulcerative colitis: a randomized placebo controlled
study. Gastroenterology 2005;128:1805-11.
La lettre de l’hépato-gastroentérologue - n° 4 - vol. VIII - juillet-août 2005
150
1
/
4
100%