Le Courrier de la Transplantation - Volume I - n o2 - juillet-août-septembre 2001
78
Observation inattendue
a maladie de Kaposi (MK) est carac-
térisée par la prolifération de cel-
lules fusiformes (cellules kaposiennes)
ménageant des fentes vasculaires sous
l’influence d’un virus du groupe herpès,
le HHV8 (Human Herpes Virus 8). On en
distingue quatre formes cliniques :
!la MK classique ou “méditerranéenne”,
touchant en règle des sujets âgés de plus
de 50 ans, originaires du bassin méditer-
ranéen, d’évolution lente et bénigne ;
!la MK endémique africaine, intéres-
sant des sujets plus jeunes, originaires
d’Afrique subsaharienne (centrale ou de
l’Est), d’évolution souvent comparable à
la précédente ;
!la MK épidémique, associée au sida ;
!la MK secondaire aux immunodépres-
sions iatrogènes, notamment après trans-
plantation d’organe (1).
Quelles sont les particularités de la MK
du transplanté ? Quelles en sont les
modalités de prise en charge ? Quelles
sont les perspectives d’avenir dans cette
maladie ? À partir d’un cas clinique
simple, nous tenterons de répondre à ces
questions.
CAS CLINIQUE
Un homme de 46 ans, originaire de Gui-
née et vivant en France depuis 1986, a subi
une première transplantation rénale le
23 juin 1998. Il a pour principal antécé-
dent une hypertension artérielle (HTA)
sévère ancienne, responsable d’une insuf-
fisance rénale terminale par néphroangio-
sclérose ayant conduit à la dialyse en 1996.
La greffe d’un rein cadavérique ayant
quatre compatibilités HLA est suivie d’une
reprise de diurèse immédiate, et la biopsie
rénale à trois mois est considérée comme
normale. Le protocole d’immunodépres-
sion (protocole SIMULECT) associe ciclo-
sporine (300 mg/j avant la greffe, puis
adaptée au T0 : 200 mg/225 mg), azathio-
prine (150 mg/j avant la greffe, puis
adaptée à la leucocytose, soit 125 mg/j) et
prednisone (initialement 1 mg/kg/j, puis
diminution progressive).
Le patient est réhospitalisé 17 mois après
la greffe pour une altération de l’état
général associant anorexie et amaigrisse-
ment de 5 kg, épigastralgies et apparition
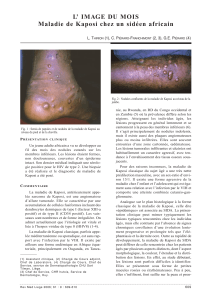
de nodules et plaques de 6 à 10 mm de
diamètre infiltrés sur l’avant-bras gauche,
la cuisse gauche et la jambe droite
(figures 1 et 2). Il est alors sous 100 mg
x2/j de ciclosporine, 75 mg/j d’azathio-
prine et 10 mg/j de prednisone. La créa-
tinine est stable à 150 µmol/l, le greffon
est fonctionnel. L’hypothèse d’une mala-
die de Kaposi chez ce malade immuno-
déprimé est confirmée par la biopsie cuta-
née d’un élément de l’avant-bras. Celle-ci
met en effet en évidence, sous un épi-
derme normal, une prolifération faite de
très nombreuses cavités et fentes vascu-
laires bordées par des cellules fusiformes
aux noyaux volumineux associées à un
infiltrat inflammatoire comportant des
lymphocytes, des plasmocytes et de nom-
breux sidérophages. La PCR HHV8 est
Maladie de Kaposi post-transplantation rénale
1Service de dermatologie, hôpital Saint-Louis,
assistance publique des hôpitaux de Paris, 75475
Paris Cedex 10.
2Service de médecine interne, hôpital La Pitié-
Salpêtrière, Assistance publique des hôpitaux de
Paris, 75651 Paris Cedex 13.
3Service de néphrologie, hôpital Saint-Louis,
Assistance publique des hôpitaux de Paris, 75475
Paris Cedex 10.
4Unité de virologie, laboratoire de microbiologie,
hôpital Saint-Louis, 75475 Paris Cedex 10.
"J. Wendling1, C. Francès2, E. Thervet3,
F. Agbalika4, F. Morinet4, J. Bedrossian3,
P. Morel1, Ch. Legendre3, C. Lebbé1
La maladie de Kaposi (MK) est associée à l’herpèsvirus
humain de type 8 (HHV8). Il s’agit d’une maladie cutanéo-
muqueuse et/ou viscérale caractérisée par la prolifération
de cellules dérivant de l’endothélium lymphatique, sous l’influence du HHV8. La MK post-
transplantation n’a pas de spécificité clinique par rapport aux autres formes de MK. En
revanche, sa prise en charge est bien différente, puisque basée sur la levée progressive de
l’immunodépression. De nouvelles techniques de biologie moléculaire peuvent aider au dia-
gnostic (PCR HHV8 à partir des tissus) ; d’autres, comme l’analyse de la virémie quantita-
tive HHV8, ont peut-être une valeur pronostique.
Mots-clés :
Maladie de Kaposi - HHV8 - Transplantation - Levée de l’immunosuppression.
Résumé
Résumé
L
Figure 1. Plaque infiltrée et nodule de
Kaposi sur la jambe.

fortement positive sur la peau (3,5 x
106copies/µg d’ADN). Le bilan d’exten-
sion retrouve des plages érythémateuses
gastriques sans image histologique spéci-
fique ; la coloscopie met en évidence un
petit nodule de l’angle droit dont l’histo-
logie est là encore non spécifique. La
radiographie thoracique et le scanner tho-
raco-abdominal sont normaux. Il n’y a pas
de point d’appel pour une autre néoplasie
ou infection opportuniste concomitante.
Un traitement associant ganciclovir
5mg/kg/12 h et ribavirine 10 mg/kg/8 h
à J1 puis 5 mg/kg/8 h de J2 à J10 est com-
mencé fin novembre 1999, afin d’inhiber
la réplication du HHV8, sans modifica-
tion initiale du traitement immunosup-
presseur. Le ganciclovir est relayé per os
à 150 mg x 2/j après sept jours de traite-
ment parentéral et poursuivi pendant
six semaines.
Cependant, devant la persistance de l’évo-
lutivité des lésions cutanées avec d’impor-
tantes douleurs à la jambe droite,
trois semaines après le début du traitement
antiviral, le traitement immunosuppresseur
est modifié. Ainsi, l’azathioprine est arrê-
tée mi-décembre 1999 et la posologie de
la ciclosporine est diminuée à 175 mg/j
à partir de fin décembre 1999, puis à 75 mg
x2/j à partir de fin janvier 2000.
L’évolution clinique est marquée par une
stabilisation de la MK dès le premier
mois suivant la diminution du traitement
immunosuppresseur, puis par une amé-
lioration spectaculaire notée à la mi-
février 2000, avec désinfiltration de
toutes les lésions et persistance d’un dis-
cret lymphœdème de la jambe droite. Par
ailleurs, l’état général s’est rapidement
amélioré.
Après un an de rémission, on assiste en
mars 2001 à une reprise évolutive limi-
tée des lésions cutanées sous forme d’un
lymphœdème kaposien de la jambe droite
et de trois nodules du pied homolatéral.
Un nouveau bilan d’extension est donc
réalisé 16 mois plus tard (mars 2001),
alors que le malade est toujours sous
ciclosporine (75 mg x 2) et 10 mg de
prednisone. Il associe un TDM thoraco-
abdomino-pelvien et une FOGD, et est
totalement négatif. Cette reprise évolu-
tive, comparable aux poussées observées
dans la MK classique ou épidémique,
n’est pas expliquée par l’existence d’une
infection opportuniste concomitante ni
par des modifications du traitement
immunosuppresseur. Un traitement par
thalidomide, inhibiteur de l’angiogenèse,
va être prochainement introduit.
DISCUSSION
Il s’agit d’une observation relativement
typique de maladie de Kaposi post-trans-
plantation rénale. Le délai d’apparition de
la maladie, ici de 17 mois, est conforme
au délai observé dans la littérature, qui
est en moyenne de 20 mois après la greffe
(valeurs variant de quelques semaines à
18 ans) (1).
Le HHV8 a été découvert en 1994 par
analyse de la différence de la représenta-
tion à partir de tissu kaposien (2). Il
appartient à la famille des Herpesviridae,
à la sous-famille des herpesvirinae et au
genre des rhadinovirus. Sa responsabilité
dans la MK est fondée sur la constance
de l’association, son caractère spécifique,
puisqu’en dehors de la MK, le HHV8
n’est associé qu’à un nombre très limité
de pathologies humaines (essentielle-
ment lymphome primitif des séreuses,
maladie de Catleman multicentrique), la
précession de l’infection HHV8 à l’ap-
parition d’une MK, les données épidé-
miologiques. La prévalence de la MK
post-transplantation rénale varie selon les
régions. Elle est par exemple de 0,45 %
en Ile-de-France, mais plus élevée
(4,1 %) dans les pays du Bassin méditer-
ranéen ou du Moyen-Orient, comme
l’Arabie saoudite ; ces données peuvent
être mises en parallèle avec la séropréva-
lence HHV8, variable selon les zones
géographiques : faible, de l’ordre de 1 à
5% chez des donneurs de sang dans les
régions occidentales, élevée dans les pays
du Bassin méditerranéen ou en Afrique
subsaharienne (30 % en Italie du Sud,
51 % en Ouganda) (3). Enfin, le HHV8
code pour différents gènes susceptibles
de déréguler le cycle cellulaire, de sti-
muler l’angiogenèse et d’inhiber l’apop-
tose potentiellement impliqués dans la
physiopathologie de la MK. D’ailleurs,
un modèle de souris transgénique
pour un de ces gènes viraux (orf74) est
caractérisé par la survenue de tumeurs
cutanées multicentriques proches de la
MK (4).
La MK post-greffe survient le plus
souvent par réactivation du HHV8 secon-
daire à l’immunodépression (5). Plus
rarement, elle est secondaire à la trans-
mission du virus par le greffon issu d’un
donneur contaminé (6). Le risque de
transmission du HHV8 par la transplan-
tation d’organe existe donc et son appré-
ciation fait l’objet d’une étude actuelle-
Le Courrier de la Transplantation - Volume I - n o2 - juillet-août-septembre 2001
79
Observation inattendue
Figure 2. Nodule de Kaposi typique sur l’avant-bras.

ment en cours. Les principaux modes de
contamination sont cependant le mode
intrafamilial, notamment dans les popu-
lations à forte séroprévalence, et le mode
sexuel. La transmission par les dérivés du
sang semble rare dans les conditions
actuelles de transfusion en Occident (3).
Aspect clinique et histologique,
profil évolutif
Le cas clinique choisi illustre bien l’as-
pect clinique de la MK post-transplanta-
tion. En effet, les lésions cutanées exis-
tent dans plus de 90 % des cas, et
permettent en règle le diagnostic. Les
lésions élémentaires sont des macules, des
plaques érythémateuses et violines s’in-
filtrant progressivement. Ces lésions ne
disparaissent pas à la vitropression et
prennent volontiers un aspect ecchymo-
tique, hémorragique ou pigmenté. Peu-
vent s’y associer ou s’observer de façon
isolée des nodules angiomateux de consis-
tance dure ou, plus rarement, des nodules
lymphangiectasiques de consistance mol-
lasse. Un lymphœdème peut accompa-
gner les lésions, voire être au premier
plan. La MK de l’immunodéprimé est
volontiers plus agressive que la MK clas-
sique, avec une atteinte cutanée plus ubi-
quitaire, une atteinte muqueuse et viscé-
rale plus fréquente. Les atteintes
viscérales sont retrouvées dans environ
40 % des cas (7, 8). Elles peuvent être
digestives (lésions le plus souvent révé-
lées par l’endoscopie, se présentant sous
forme de macules érythémateuses plus ou
moins infiltrées), pulmonaires (infiltrats
interstitiels ou nodules), ganglionnaires
et, plus rarement, osseuses, hépatiques ou
spléniques, voire cardiaques. On notera
que le diagnostic histologique des
lésions digestives peut être difficile du fait
de la profondeur de l’infiltrat, ce qui peut
conduire à une sous-estimation de la fré-
quence de ces atteintes. Il peut toutefois
être sensibilisé en réalisant une PCR sur
les lésions (sensibilité de 90 à 100 %).
Enfin,le profil évolutif de la maladie chez
notre patient est celui observé dans la
majorité des cas, avec régression ou
stabilisation de la maladie à la levée de
l’immunosuppression chez 18 patients
sur 20 dans une série récente (9). La
réponse complète est obtenue dans 17 à
81 % des cas s’il existe des lésions pure-
ment cutanées et dans 0 à 50 % des cas en
cas de manifestations viscérales associées
(7-10). Ce cas clinique illustre donc les
difficultés de la prise en charge de cette
maladie chez le transplanté. En effet,
l’élément décisif dans le traitement est
alors la décision de levée progressive de
l’immunosuppression, qui fait courir au
patient le risque d’un rejet, et donc d’un
retour en dialyse. La décision de la baisse
de l’immunosuppression doit tenir
compte, après information du patient, de
plusieurs facteurs comme une localisation
viscérale grave du Kaposi, un retentisse-
ment fonctionnel important des lésions
cutanées ou une évolutivité importante
des lésions. Il est certain que la difficulté
est encore plus grande lorsqu’il s’agit
d’une transplantation hépatique, pulmo-
naire ou cardiaque. L’attitude adoptée
habituellement, mais de façon empirique,
est de diminuer dans un premier temps les
corticoïdes, puis de diminuer ou d’arrêter
l’inhibiteur de synthèse de base purique
(azathioprine ou mycophénolate mofétil),
et enfin, si nécessaire, de diminuer pro-
gressivement les anticalcineurines.
Modalités thérapeutiques
Un traitement antiviral associant ganciclo-
vir et ribavirine a été essayé chez notre
patient. On sait que certains analogues
nucléosidiques tels que ganciclovir, fosca-
vir ou cidofovir inhibent in vitro la répli-
cation du HHV8 dans des lignées de lym-
phomes primitifs des séreuses (11). Ils ont
peut-être un intérêt préventif en clinique
(12), mais leur efficacité in vivo sur des
MK établies n’a pas été démontrée. Cela
est sans doute lié au mécanisme d’action
de ces antiviraux, qui inhibent l’ADN poly-
mérase avec pour cible les cellules infec-
tées par un HHV8 en phase de réplication
lytique. Or, dans la MK, le HHV8 infecte
95 % des cellules sous un mode latent, tan-
dis que moins de 5 % des cellules héber-
gent un virus réactivé, aboutissant à la lyse
cellulaire. L’association à la ribavirine avait
pour intérêt théorique d’inhiber la matura-
tion des ARN messagers viraux et de cibler
ainsi les cellules infectées sur un mode
latent. Si cette association est difficilement
évaluable chez notre patient du fait de la
diminution rapide de l’immunosuppres-
sion, elle n’a pas non plus permis d’obte-
nir une régression de lésions cutanées chez
5patients souffrant de MK classique
(C. Lebbé, Journées dermatologiques de
Paris 2001, communication personnelle).
Les chimiothérapies classiques ont sur-
tout été évaluées dans la MK associée au
VIH, mais elles peuvent avoir un intérêt
dans la MK post-transplantation (13). En
monochimiothérapie, on peut utiliser la
bléomycine, antibiotique antimitotique
utilisé par voie intramusculaire tous
les 15 à 21 jours ou par perfusion intra-
veineuse tous les 15 jours. Elle a pour
avantage une très faible hématotoxicité,
mais présente une toxicité pulmonaire
(dose cumulée) et cutanée. Elle offre de
bons taux de réponse dans les localisa-
tions cutanéo-muqueuses, de l’ordre de
48 à 74 %. On peut également utiliser la
vinblastine (alcaloïde de la pervenche),
qui permet d’obtenir des réponses par-
tielles de l’ordre de 26 % au prix, parfois,
d’une toxicité hématologique et neurolo-
gique (neuropathies périphériques). Elle
s’utilise à 0,1 mg/kg/semaine. La vin-
cristine, un autre alcaloïde de la per-
venche utilisé à 2 mg i.v./semaine,
semble donner de meilleurs résultats
(60 % de réponses partielles), avec une
toxicité hématologique moindre, mais
une toxicité neurologique supérieure.
Enfin, l’étoposide, inhibiteur de la topo-
isomérase II, a permis d’obtenir des
réponses dans 32 à 76 % des cas, avec
notamment des réponses viscérales.
Cependant, il est responsable d’une toxi-
cité hématologique importante, ce qui
n’en fait pas un traitement de première
intention. D’autres monochimiothérapies
telles que les anthracyclines liposomales
(doxorubicine liposomale et daunorubi-
cine liposomale) ou les taxanes ont une
efficacité supérieure, permettant notam-
ment des réponses sur des localisations
viscérales sévères (taux de réponse
estimés à 43-79 % et 60-70 % respecti-
vement). La toxicité hématologique n’est
pas négligeable, surtout sur des patients
déjà immunodéprimés. Ces traitements
peuvent donc avoir un intérêt à court
terme, mais n’ont, en l’absence de levée
parallèle de l’immunodépression, qu’une
efficacité temporaire (13).
Le Courrier de la Transplantation - Volume I - n o2 - juillet-août-septembre 2001
80
Observation inattendue

Le Courrier de la Transplantation - Volume I - n o2 - juillet-août-septembre 2001
81
Observation inattendue
Des molécules de la famille des
rétinoïdes, comme l’acide tout-transréti-
noïque, ayant des propriétés antiproliféra-
tives directes, mais aussi immunomodu-
latrices et inhibitrices de l’angiogenèse,
ont permis d’obtenir 40 % de réponses ou
de stabilisation chez des patients ayant
une MK VIH-positifs et peu immunodé-
primés (CD4 > 200). Le thalidomide,
présentant également des propriétés inhi-
bitrices de l’angiogenèse, a permis d’ob-
tenir 40 % de réponses chez des patients
VIH+ peu immunodéprimés sous trithé-
rapie antirétrovirale. Des résultats
intéressants mais très préliminaires sont
rapportés avec d’autres molécules inhi-
bitrices de l’angiogenèse. L’interféron
alpha, molécule efficace dans la maladie
de Kaposi classique, est contre-indiqué
chez le greffé en raison du risque de rejet.
Les traitements locaux peuvent avoir un
intérêt pour des formes pauci-lésion-
nelles ou peu évolutives. Il s’agit essen-
tiellement de la cryothérapie, de la cryo-
chirurgie, du laser CO2,voire de la
chirurgie. La radiothérapie externe est a
priori à éviter chez les greffés (13).
CONCLUSION
Il faut savoir penser à la MK devant des
lésions cutanées violacées plus ou moins
infiltrées et, parfois, devant un simple
lymphœdème chez un immunodéprimé.
La difficulté de sa prise en charge est
dominée par la nécessité d’une baisse de
l’immunosuppression (pour les formes
sévères) au prix d’un risque de rejet et de
retour en dialyse estimé de 11 à 40 %
pour les formes dermatologiques et de 0
à 69 % pour les formes viscérales (8).
Une étude nationale est en cours pour
mieux connaître les facteurs de risque
qui, associés à l’infection HHV8, favori-
sent l’apparition d’une MK chez le trans-
planté, et pour étudier la valeur prédic-
tive du suivi de la virémie quantitative
HHV8 chez ces malades. #
RÉFÉRENCES
BIBLIOGRAPHIQUES
1. Tappero JW, Conant MA, Wolfe SF, Berger TG.
Kaposi’s sarcoma. Epidemiology, pathogenesis, his-
tology, clinical spectrum, staging criteria and thera-
py. J Am Acad Dermatol 1993 ; 28 : 371-95.
2. Chang Y, Cesarman E, Pessin MS et al.
Identification of herpesvirus-like DNA sequences in
AIDS-associated Kaposi’s sarcoma. Science 1994 ;
266 : 1865-9.
3. Sarid R, Olsen SJ, Moore PS. Kaposi’s sarcoma-
associated herpesvirus : epidemiology, virology, and
molecular biology. Adv Virus Res 1999 ; 52 : 139-232.
4. Yang TY, Chen SC, Leach MW et al. Transgenic
expression of the chemokine receptor encoded by
human herpesvirus 8 induces an angioproliferative
disease resembling Kaposi’s sarcoma. J Exp Med
2000 ; 191 : 445-54.
5. Parravicini C, Olsen SJ, Capra M et al. Risk of
Kaposi’s sarcoma-associated herpesvirus transmis-
sion from donor allografts among Italian post-
transplant Kaposi’s sarcoma patients. Blood 1997 ;
90 : 2826-9.
6. Regamey N, Tamm M, Wernli M et al.
Transmission of human herpesvirus 8 infection from
renal-transplant donors to recipients. N Engl J Med
1998 ; 339 : 1358-63.
7. Penn I. Sarcomas in organ allograft recipients.
Transplantation 1995 ; 60 : 1485-91.
8. Frances C. Kaposi’s sarcoma after renal trans-
plantation. Nephrol Dial Transplant 1998 ; 13 :
2768-73.
9. Barete S, Calvez V, Mouquet C et al. Clinical fea-
tures and contribution of virological findings to the
management of Kaposi’s sarcoma in organ-allograft
recipients. Arch Dermatol 2000 ; 136 : 1452-8.
10. Montagnino G, Bencini PL, Tarantino A,
Caputo R, Ponticelli C. Clinical features and
course of Kaposi’s sarcoma in kidney transplant
patients : report of 13 cases. Am J Nephrol 1994 ;
14 : 121-6.
11. Kedes DH, Ganem D. Sensitivity of Kaposi’s
sarcoma-associated herpesvirus replication to anti-
viral drugs. Implications for potential therapy. J Clin
Invest 1997 ; 99 : 2082-6.
12. Martin DF, Dunn JP, Davis JL et al. Use of the
ganciclovir implant for the treatment of cytomegalo-
virus retinitis in the era of potent antiretroviral the-
rapy : recommendations of the International AIDS
Society-USA panel. Am J Ophthalmol 1999 ; 127 :
329-39.
13. Dezube BJ. New therapies for the treatment of
AIDS-related Kaposi’s sarcoma [In Process
Citation]. Curr Opin Oncol 2000 ; 12 : 445-9.
1
/
4
100%