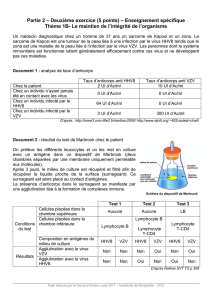
Extrait du guide des analyses spécialisées Cerba

Herpès virushumain de type 8
(HHV8)
Le virus HHV8, aussi appelé précédemment KSHV
(pour Kaposi’s sarcoma associated herpes virus), aété
identifié en 1994 par une technique d’amplification dif-
férentielle àpartir de cellules de lésion de sarcome de
Kaposi associé au sida. C’est le premier herpès virus à
avoir été identifié par biologie moléculaire, les 7autres
ayant été isolés par culture cellulaire.
Agent viral
HHV8 est un virus de la famille des Herpesviridae,de
la sous-famille des Gammaherpesvirinae,etdugenre
Rhadinovirus.C’est le seul rhadinovirus connu chez
l’homme. Tous les autres virus de cette sous-famille des
Gammaherpesvirinae,dont le virus d’Epstein-Barr fait
partie, sont responsables de tumeurs chez leur hôte
naturel.
Ce virion aune taille de 110 à150 nm. Il est enveloppé
et possède une capside de symétrie icosaédrique. Le
génome est constitué d’une molécule d’ADN bicaté-
naire d’environ 170 kb composée d’une longue région
unique de 140 kb contenant près de 90 gènes, encadrée
de séquences terminales répétées. Quinze de ces gènes
ne possèdent aucune homologie avec ceux d’autres
herpès virus. Ils ont été nommés de K1 àK15. La varia-
bilité du génome permet de différencier 5sous-types
viraux :les sous-types AetCprédominent en Europe
du Sud et dans le Bassin méditerranéen, le sous-type B
est présent en Afrique subsaharienne, le sous-type Dse
rencontre dans les îles du Pacifique et le Japon et le
sous-type Einfecte certaines populations des Indiens
d’Amérique du Sud.
Physiopathologie
L’HHV8 est un virus qui se cultive difficilement. Les
rares isolats primaires obtenus proviennent de lignées
établies àpartir de prélèvements de lymphomes des
cavités. In vitro,plusieurs équipes ont montré que de
nombreuses cellules pouvaient être infectées (cellules
endothéliales, kératinocytes) mais la production virale
est faible, l’infection latente difficile et la persistance
virale ne se faisant qu’à court terme, les cellules infec-
tées ne sont pas transformées ni immortalisées. In vivo,
l’HHV8 est présent dans les lymphocytes B, les mono-
cytes, les cellules fusiformes du sarcome de Kaposi et
les cellules des lymphomes primitifs des séreuses. Parmi
les 90 gènes de l’HHV8, certains codent des protéines
requises lors de la réplication et l’assemblage des parti-
cules virales, d’autres codent pour des protéines dont le
rôle est de moduler la réponse immunitaire, l’apoptose
et la croissance cellulaire. Comme tous les herpès virus,
l’HHV8 est latent dans la majorité des cellules qu’il
infecte. Il est capable de réactivation avec passage en
phase de réplication lytique, libération de particules
virales et lyse cellulaire. Alors que les gènes de latence
sont exprimés dans la majorité des cellules tumorales et
dans les cellules fusiformes, seul un faible pourcentage
exprime les gènes de réplication lytique. Cette présence
àbas bruit suggère l’importance du produit de ces gènes
dans la physiologie des maladies tumorales.
Épidémiologie
L’infection par HHV8 n’est pas ubiquitaire. Dans la
population adulte, la séroprévalence est de moins de
5%dans les pays occidentaux (États-Unis, Europe du
Nord) et en Asie du Sud-Est. Elle augmente de 10 à
20 %dans les pays du Bassin méditerranéen (Italie,
Grèce), en Amérique du Sud et en Afrique de l’Ouest,
et dépasse 50 %dans certaines régions d’Afrique de
l’Est et de l’Afrique centrale.
En Europe du Nord et en Amérique du Nord, HHV8
est transmis préférentiellement par voie sexuelle. En
France, les IgG sont présentes chez 3,2 %des donneurs
de sang mais chez 29 %des sujets àrisque sexuel non
infectés par le VIH et 60 %des sujets àrisque sexuel
infectés par le VIH.
En revanche, en Afrique, en zone de forte endémie,
la séroprévalence est très élevée dans l’enfance, après
l’âge de 2ans, évoquant une transmission horizontale
de l’HHV8 de la mère àl’enfant ou d’enfant àenfant
au sein de la même fratrie, par contacts rapprochés
ou partage d’ustensiles domestiques plutôt qu’une
transmission verticale lors de l’accouchement ou de
l’allaitement. La salive serait une voie de transmission
possible.
Des cas d’infection àHHV8 ont été décrits après trans-
fusion sanguine ou après transplantation d’organes à
partir de donneur infecté par ce virus.
Clinique
HHV8 est responsable de trois maladies :
•la maladie (ou sarcome) de Kaposi (MK), qui existe
sous quatre formes. Dans tous les cas, il s’agit de
tumeurs cutanées multiples liées àlaprolifération de
cellules d’origine endothéliale. Elle s’accompagne
d’une néo-angiogenèse, d’un œdème tissulaire et
d’une infiltration lymphoplasmocytaire. La MK
méditerranéenne, dite «classique », atteint surtout
les hommes âgés (sex-ratio 10/1) du sud de l’Europe,
d’Israël et du Moyen-Orient. La MK endémique

atteint enfants et adultes en Afrique équatoriale avec
un sex-ratio de 3/1. La MK post-transplant est ren-
contrée chez les greffés de rein recevant un traitement
immunosuppresseur de longue durée. La dernière
forme, dite «épidémique », la plus répandue actuelle-
ment, s’observe chez les patients infectés par le VIH.
Il s’agit de formes disséminées avec des lésions multi-
focales et une atteinte viscérale. Elle représente le pre-
mier cancer chez les sidéens. Le génome viral est
détecté dans 100 %des tumeurs de MK, quel qu’en
soit le type, et dans 50 à70%des cas dans les lym-
phocytes du sang périphérique de ces mêmes
patients ;
•la maladie de Castleman (MC) multicentrique du
patient infecté par le VIH. La MC est une affection
lymphoproliférative rare, àforme hyalino-vasculaire
ou plasmocytaire, qui peut se présenter sous une
forme localisée (mésentérique ou médiastinale) plutôt
chez le sujet jeune, ou sous une forme multicentrique,
rencontrée après 60 ans ou au cours du sida. Elle
associe alors adénopathies multiples, splénomégalie,
hépatomégalie et importante altération de l’état géné-
ral. L’association àune MK est fréquente. HHV8 est
retrouvé dans 100 %des MC multicentriques asso-
ciées au sida, mais moins fréquemment dans les autres
cas ;
•les lymphomes Bdes séreuses ou PEL (primary effu-
sion lymphoma)atteignant les cavités (plèvre, péri-
carde, péritoine) sont presque toujours associés au
sida. Le génome d’HHV8 est présent dans 100 %des
cas dans les cellules lymphomateuses, très fréquem-
ment associé àcelui d’EBV (70 %).
Le rôle d’HHV8 aété évoqué dans d’autres pathologies
(certaines hémopathies ou tumeurs vasculaires) mais
n’a pas été confirmé ou reste sujet àcontroverse.
Traitement
Le traitement du sarcome de Kaposi classique ou endé-
mique est essentiellement local :excision chirurgicale,
cryothérapie, radiothérapie ou chimiothérapie intra-
lésionnelle. Dans les formes épidémiques, la prise d’un
traitement antirétroviral (HAART) entraîne une régres-
sion des lésions. Pour les formes post-transplant, une
modification du traitement immunosuppresseur est dis-
cutée.
Les traitements anti-herpétiques (cidofovir, foscarnet et
ganciclovir) ont une action in vitro mais ne sont pas
actuellement préconisés en routine.
Diagnostic biologique
—Diagnostic direct
•Il n’existe pas de méthode d’isolement viral en
routine.
•Le diagnostic de l’infection par HHV8 repose sur la
détection directe du génome viral par PCR dans une
lésion suspecte de MK, de MC ou de PEL, ou dans
les lymphocytes du sang circulant.
•Plus récemment ont été décrites des techniques de
PCR en temps réel quantitatives qui permettent de
mesurer la charge virale en ADN HHV8 dans les lym-
phocytes circulants. La cinétique de cette charge
virale permettrait un meilleur suivi des pathologies
liées àHHV8 et de l’effet des traitements.
—Diagnostic indirect
La détection d’IgG anti-HHV8 sériques en immuno-
fluorescence indirecte sur cellules infectées (technique
de référence) ou en Elisa permet de vérifier la séro-
positivité vis-à-vis du virus. Les meilleures techniques
détectent des anticorps spécifiques dirigés contre des
antigènes de latence. Elles sont positives chez 100 %
des sarcomes de Kaposi classiques ou endémiques et
chez plus de 90 %des formes épidémiques.
(Gessain A.
Herpèsvirushumain 8. Aspects virologiques, cliniquesetépidémiolo-
giques.
EMC –MaladiesInfectieuses2005 ;8-070-B-20, 11 p.
Marcelin AG, Dupin N, Calvez V.
Herpèsvirushumain 8.
In :Huraux JM, Nicolas JC, Agut H, Peigne-Lafeuille H.
Virologie médicale.
Paris:Estem, 2003 ;pp. 237-245.
Martinez V, Dupin N.
Virusherpès humain 8etmaladie de Kaposi au coursdel’infection par
le VIH :interactionsetimpact destraitements antirétroviraux.
Lettredel’Infectiologue 2006 ;20:44-48.
1
/
2
100%