Aspects échocardiographiques de l’insuffisance mitrale ischémique M

La Lettre du Cardiologue - n° 346 - juin 2001
39
insuffisance mitrale (IM) est fréquente dans l’infarc-
tus du myocarde (de l’ordre de 20 %) et dans les
cardiopathies ischémiques chroniques. Il s’agit d’un
élément de mauvais pronostic, comme l’ont montré plusieurs
études, dont l’étude SAVE (1, 2).
L’IM correspond à des mécanismes variés, pas toujours bien com-
pris, qui suscitent à l’heure actuelle d’assez nombreux travaux
expérimentaux (3-7)dont l’impact sur l’approche chirurgicale est
indiscutable.
Les fuites mitrales sont de gravité variable et susceptibles d’évo-
luer dans le temps grâce à la stratégie de prise en charge précoce
de l’IDM. Certaines fuites apparaissent en effet dynamiques et
disparaissent à la faveur de la revascularisation (8).
L’échocardiographie joue un rôle fondamental dans le diagnostic
positif, différentiel, dans la quantification et l’analyse du méca-
nisme. Autant d’éléments à prendre en considération pour
décider de la stratégie thérapeutique. Échocardiographie trans-
thoracique (ETT) et transœsophagienne (ETO) sont à ce titre
complémentaires, avec possibilité de reconstruction tridimen-
sionnelle, afin de faciliter la discussion médico-chirurgicale.
Citons en outre l’intérêt de l’écho de stress dans l’IM chronique
lorsque l’on recherche une viabilité qui serait un argument en
faveur d’une revascularisation associée ou non à une plastie.
Enfin, l’ETO a un rôle capital en peropératoire dans le cadre du
contrôle du geste chirurgical.
PARTICULARITÉS DE L’ÉTUDE ÉCHOCARDIOGRAPHIQUE
D’UNE IM ISCHÉMIQUE
(9-11)
Analyse de l’appareil mitral : mécanisme de la fuite
L’IM ischémique peut être liée à une anomalie de l’appareil val-
vulaire (rupture totale ou partielle de pilier), mais, le plus sou-
vent, il s’agit d’une dysfonction myocardique liée à l’infarctus.
Il est donc capital de faire une étude systématisée de l’appareil
valvulaire d’une part, et du myocarde avoisinant d’autre part.
La valvule mitrale est une véritable unité anatomique et fonc-
tionnelle dont il faut préciser la taille de l’anneau, l’état des valves
(3 segments de la valve antérieure [A1, A2, A3], 3 segments de
la valve postérieure [P1, P2, P3], commissures interne et externe),
celui de l’appareil sous-valvulaire et des muscles papillaires. Rap-
pelons que chaque muscle papillaire donne des cordages en éven-
tail pour les deux hémi-valves et la commissure correspondante
et qu’en conséquence une dysfonction d’un pilier a toute chance
de retentir sur le fonctionnement de la partie correspondante des
deux valves et de la zone commissurale.
Le muscle papillaire postéromédian est le plus fragile car dans
plus de 60 % des cas, il n’est vascularisé que par une seule artère
(coronaire droite dans 80 %, circonflexe dans 20 %), le muscle
papillaire antérolatéral recevant quant à lui habituellement des
rameaux de l’interventriculaire antérieure et de la circonflexe de
la postérolatérale.
Cette analyse de la valvule mitrale permettra de classifier l’IM
selon la classification de Carpentier (figure 1, p. 40) :
– type 1 : dilatation de l’anneau (rare),
– type 2 : prolapsus valvulaire,
– type 3 : restriction de mouvement (très fréquent).
Le doppler couleur est d’une aide précieuse dans cette classifi-
cation car la direction du jet est classiquement étroitement liée
au mécanisme de l’IM.
MISE AU POINT
Aspects échocardiographiques
de l’insuffisance mitrale ischémique
●
R. Roudaut*
* Service de cardiologie, hôpital cardiologique du Haut-Lévêque, CHU de
Bordeaux.
■
L’insuffisance mitrale ischémique est fréquente, mais
probablement moins qu’autrefois grâce à la revascula-
risation précoce de l’infarctus du myocarde.
■
Il s’agit d’un élément de mauvais pronostic.
■L’échocardiographie est l’examen de choix de dia-
gnostic positif, étiologique et de gravité.
■À l’heure de la chirurgie réparatrice, l’analyse précise
du mécanisme de la fuite est primordiale dans la stra-
tégie thérapeutique, qui sera discutée au cas par cas.
Points forts
L
‘

40
Quantification de la fuite
L’échocardiographie intervient également de façon cruciale dans
la quantification de la fuite en gardant en mémoire que la régur-
gitation est avant tout dépendante de trois paramètres : la taille
de l’orifice régurgitant, la postcharge ventriculaire et la durée de
la systole. Une IM risque d’être sous-estimée en cas de bas débit.
D’autre part, tout événement ischémique risque d’aggraver l’IM ;
à l’inverse, il est courant de nos jours de voir disparaître une IM
après revascularisation par angioplastie.
La quantification de l’IM fera appel aux critères classiques et plus
modernes que sont la planimétrie, le diamètre du jet à l’origine,
la PISA, la fraction de régurgitation, le rapport de l’ITV...
Étude de la fonction ventriculaire gauche régionale
Enfin,l’analyse des anomalies segmentaires de contraction est
une étape fondamentale dans l’approche de cette pathologie : elle
doit être basée sur la segmentation du ventricule gauche recom-
mandée par l’American Society of Echocardiography (ASE)
(16 segments). L’exploration de ces 16 segments est réalisable en
ETT, d’autant plus que l’imagerie d’harmonique améliore gran-
dement la qualité de l’image ; elle nécessite classiquement la réa-
lisation d’au moins quatre coupes : parasternale grand axe (ou
apicale 3 cavités), parasternale petit axe (passant au niveau du
corps du VG), apicale des 4 cavités, apicale des 2 cavités antéro-
inférieures.
LES DIFFÉRENTS TYPES D’IM ISCHÉMIQUES À LA PHASE
AIGUË DE L’IDM
(12-16)
Rupture de piliers ou d’un chef musculaire (IM type 2)
(12, 13)
Il s’agit d’une cause rare (1 % des IDM) mais grave (50 % de
décès dans les 24 h, 90 % de décès dans la semaine) et chirurgi-
cale. En fait, la gravité clinique est fonction de la rupture totale
ou partielle du muscle papillaire en sachant qu’anatomiquement,
d’un individu à l’autre, il existe de grandes variations concernant
l’anatomie des muscles papillaires, qui peuvent être constitués
d’un seul muscle principal ou de plusieurs chefs distincts.
La rupture totale de pilier est gravissime, se traduisant par un
tableau de choc cardiogénique, parfois en dehors de tout souffle
(IM massive). Il s’agit souvent de primo-infarctus et, de plus,
d’un infarctus de petite taille touchant préférentiellement le
muscle papillaire postéromédian. Sur le plan échocardiogra-
phique, le diagnostic est basé sur la mise en évidence d’une IM
massive, et d’un écho anormal correspondant au pilier rompu
animé d’un mouvement de va-et-vient entre le VG et l’OG au
cours du cycle cardiaque. Classiquement, les cavités gauches sont
peu ou pas dilatées, les pressions droites sont élevées.
La rupture partielle de pilier (figures 2 et 3) correspond soit à
une rupture d’un seul chef musculaire, soit à une rupture incom-
plète entraînant une “élongation” du pilier avec risque d’aggra-
M
ISE AU POINT
12
3
Figure 1. Représentation schématique des trois types d’IM ischémique
selon la classification de Carpentier :
Type 1 : dilatation de l’anneau.
Type 2 : prolapsus (en haut : rupture complète de pilier et capotage dans
l’oreillette gauche ; en bas : rupture partielle de pilier aboutissant à une
élongation de la valve postérieure et à un jet d’IM dirigé vers le toit de
l’OG).
Type 3 : restrictive sur infarctus postéro-basal.
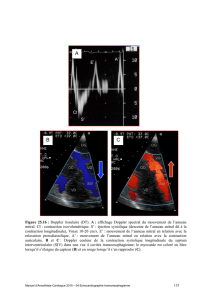
Figure 2. Rupture d’un chef musculaire.
a : en ETT, masse hypermobile appendue à l’appareil valvulaire ;
b : en ETO, prolapsus de cette masse dans l’OG en systole.
2a
2b

La Lettre du Cardiologue - n° 346 - juin 2001
41
vation secondaire. Il est capital de reconnaître ces anomalies, et
de mettre à profit l’intervalle libre pour la chirurgie.
Le tableau clinique est donc classiquement moins bruyant, avec
un risque de détérioration secondaire.
Sur le plan échocardiographique, l’IM est de gravité variable, et
correspond à un type 2 de la classification de Carpentier avec
aspect de prolapsus, voire de rupture de cordages. Ces anomalies
prédominent au niveau du muscle papillaire postmédian et tou-
chent donc peu ou prou les deux hémi-valves correspondantes et
la commissure interne.
Le dysfonctionnement de pilier (IM type 3)
La dysfonction de pilier est la cause la plus fréquente d’IM isché-
mique ; elle correspond le plus souvent à une atteinte du muscle
papillaire postéromédian, mais elle peut également toucher le
muscle papillaire antérolatéral. Typiquement, il s’agit d’une IM
restrictive de type 3 de la classification de Carpentier, c’est-à-dire
que l’appareil valvulaire en lui-même est intact, mais que la
dysfonction valvulaire est liée à l’anomalie segmentaire de
contraction sous-jacente.
Sur le plan échocardiographique, l’IM restrictive se traduit en
incidence parasternale petit axe par un mouvement en “piston”
des piliers liés à l’asynchronisme de contraction. La restriction
de mouvement prédomine souvent sur la valve postérieure, peu
mobile en systole, qui perd son rôle de butoir pour la valve anté-
rieure. Il en résulte un aspect de pseudo-prolapsus de grande valve
et une régurgitation orientée vers le plancher de l’OG.
Ces IM restrictives sont susceptibles de régresser après revascu-
larisation par angioplastie, comme l’a bien démontré l’étude de
Hickey (17), ou après revascularisation chirurgicale (selon l’im-
portance de la fuite, une annuloplastie sera associée à la revas-
cularisation).
IM centrale par remodelage ventriculaire
(figure 4)
Un troisième type d’IM (type 1) peut compliquer un IDM aigu.
Il s’agit d’une IM centrale de type 1 selon la classification de
Carpentier, souvent peu volumineuse. Elle complique avant tout
les infarctus antérieurs massifs. Son mécanisme est en réalité
complexe et intriqué. L’expansion de la zone infarcie entraîne un
M
ISE AU POINT
Figure 3. Rupture d’un chef musculaire.
a : en ETO, écho anormal appendu à la valve mitrale antérieure prolabant
dans l’OG en systole ;
b : en ETO, IM orientée vers la paroi latérale de l’OG ;
c : en ETO, incidence transgastrique, le muscle papillaire postéromédian
(MPPM) est bien visible, avec un aspect de déchirure partielle.
3a
3b
3c
Figure 4. IM centrale de type 1 dans un contexte de volumineux infarc-
tus antérieur.

La Lettre du Cardiologue - n° 346 - juin 2001
42
remodelage ventriculaire, une dilatation de la partie postérieure
de l’anneau ; il en résulte une certaine restriction par étirement
des deux muscles papillaires (IM type 3).
LES DIFFÉRENTS TYPES D’IM ISCHÉMIQUE DANS LA
CARDIOPATHIE ISCHÉMIQUE CHRONIQUE
Dans la cardiopathie ischémique (18, 19) chronique, l’IM n’est pas
rare et peut correspondre à plusieurs mécanismes et plusieurs
contextes cliniques. Il n’y a rien de comparable entre la myocar-
diopathie dilatée sévère sans viabilité résiduelle, associée à une IM
dont le pronostic est péjoratif, et l’attitude thérapeutique mal codi-
fiée (en particulier en ce qui concerne un éventuel geste sur la mitrale)
et, à l’inverse, une IM accompagnant un infarctus plus limité revas-
cularisable, ou un anévrisme justiciable d’une chirurgie.
On peut donc décrire trois situations, tout en sachant que les méca-
nismes peuvent être intriqués :
IM chronique par fibrose de pilier (type 3)
Elle complique un infarctus le plus souvent inférieur ; l’IM est
de type restrictif, favorisée par une akinésie, voire une dyskiné-
sie d’un pilier dans une zone nécrosée amincie plus ou moins
étendue.
Si la paroi est amincie et hyperéchogène, elle est le témoin d’une
cicatrice fibreuse irréversible. Il est par contre intéressant de
rechercher une viabilité par échocardiographie de stress lorsque
l’anomalie segmentaire de contraction se limite à une akinésie
sans amincissement franc.
IM chronique associée à un anévrisme VG
Les mécanismes sont variables selon le type d’anévrisme :
– Anévrisme antérieur : dans ce cas l’IM est classiquement du
type 1, centrale par dilatation de l’anneau, elle-même secondaire
au remodelage VG. Une restriction de mouvement (type 3) est
fréquemment associée par déplacement et attraction des deux
muscles papillaires par l’anévrisme.
– Anévrisme postérieur : il est responsable d’une IM de type 3
par restriction de mouvement de l’hémivalve correspondant au
muscle papillaire concerné ; il s’agit le plus souvent du muscle
papillaire postéromédian.
IM chronique associée à une myocardiopathie dilatée
Fibrose et restriction de mouvement se conjuguent pour partici-
per à cette IM. Dans ces situations, parmi les plus difficiles, le
pronostic est avant tout lié à l’extension de l’atteinte ventriculaire
gauche.
CONCLUSION
L’échocardiographie, avec ses différentes modalités, joue un rôle
de plus en plus décisif dans la prise en charge de l’IM ischémique.
En fonction du contexte aigu ou chronique et de la complexité du
tableau, on fera appel à l’échocardiographie transthoracique, ou
à l’échocardiographie transœsophagienne avec possibilité de
reconstruction tridimensionnelle, voire à l’échocardiographie de
stress. L’échocardiographie transœsophagienne peropératoire est
un complément indispensable en matière de plastie. ■
Bibliographie
1. Lamas GA, Mitchell GF, Flaker GC et al. Clinical significance of mitral regur-
gitation after acute myocardial infarction. Circulation 1997 ; 96 : 827-33.
2. Feinberg MS, Schwammenthal E, Shlizerman L et al. Prognostic significance
of mild mitral regurgitation by color doppler echocardiography in acute myocar-
dial infarction. Am J Cardiol 2000 ; 86 : 903-7.
3. Otsuji Y, Handschumacher MD, Schwammenthal E et al. Insights from three-
dimensional echocardiography into the mechanism of functional mitral regurgita-
tion. Direct in vivo demonstration of altered leaflet tethering geometry.
Circulation 1997 ; 96 : 1999-2008.
4. Otsuji Y, Handschumacher MD, Liel-Cohen N et al. Mechanism of ischemic
mitral regurgitation with segmental left ventricular dysfunction : three-dimen-
sional echocardiographic studies in models of acute and chronic progressive
regurgitation. J Am Coll Cardiol 2001 ; 37 : 641-8.
5. Gorman JH, Gorman RC, Jackson BM et al. Distorsions of the mitral valve in
acute ischemic mitral regurgitation. Ann Thor Surg 1997 ; 64 : 1026-31.
6. Gorman JH, Gorman RC, Plappert T et al. Infarct size and location determine
development of mitral regurgitation in the sheep model. J Thorac Cardiovasc Surg
1998 ; 115 : 615-22.
7. Glasson JR, Komeda M, Daughters GT et al. Early systolic mitral leaflet
“loitering” during acute ischemic mitral regurgitation. J Thorac Cardiovasc Surg
1998 ; 116 : 193-205.
8. Lehmann KG, Francis LK, Sheehan FH, Dodge HJ and the TIMI study group.
Effect of thrombolysis on acute mitral regurgitation during evolving myocardial
infarction. Experience from the thrombolysis in myocardial infarction trial
(TIMI). J Am Coll Cardiol 1993 ; 22 : 714-9.
9. Chirillo F, Cavarzerani A, Ins P et al. Role of transthoracic, transoesophageal
and transgastric two dimensional and color doppler echocardiography in the eva-
luation of mechanical complications of acute myocardial infarction. Am J Cardiol
1995 ; 76 : 833-6.
10. Izumi S, Niyatake K, Beppu S et al. Mechanism of mitral regurgitation in
patients with myocardial infarction : a study using real time two-dimensional
doppler flow imaging and echocardiography. Circulation 1987 ; 76 : 777-85.
11. Shah PM, Raney AA, Duran CMG et al. Multiplane transoesophageal echo-
cardiography : a roadmap for mitral valve repair. J Heart Valve Dis 1999 ; 8 :
625-9.
12. Thompson CR, Buller CE, Sleeper LA et al. Cardiogenic shock due to acute
severe mitral regurgitation complicating acute myocardial infarction : a report
from the Shock trial registry. Should we use emergently revascularize occluded
coronaries in cardiogenic shock ? J Am Coll Cardiol 2000 ; 36 : 1106-9.
13. Fasol R, Lakew F, Wetter S. Mitral repair in patients with a ruptured papil-
lary muscle. Am Heart J 2000 ; 139 : 549-54.
14. Calvo FE, Figueras J, Cortadellas J, Soler-Soler J. Severe mitral regurgita-
tion complicating acute myocardial infarction. Clinical and angiographic diffe-
rences between patients with and without papillary muscle rupture. Eur Heart J
1997 ; 18 : 1606 -10.
15. Van Dantzign JM, Delemarre BJ, Koster RW, Bot H, Visser CA. Pathogenesis
of miral regurgitation in acute myocardial infarction : importance of changes in
left ventricular shape and regional function. Am Heart J 1996 ; 131 : 865-71.
16. Fasol R et al. Surgery of ischaemic mitral regurgitation. Eur Heart J 1998 ;
19 : 1598-9.
17. Hickey M, Smith LR, Muhlbaierl H, Harrell FE, Reves JG. Current prognosis
of ischemic mitral regurgitation. Implications for future management. Circulation
1988 ; 78SI : I51-I59.
18. Dobre M, Koul B, Rojet A. Anatomic and physiologic correction of the res-
tricted posterior mitral leaflet motion in chronic ischemic mitral regurgitation.
J Thorac Cardiovasc Surg 2001 ; 120 : 409-11.
19. Yiu SF, Enriquez-Sarano M, Tribouilloy C, Seward JB, Tajik AJ.
Determinants of the degree of functional mitral regurgitation in patients with sys-
tolic left ventricular dysfunction. A quantitative clinical study. Circulation 2000 ;
102 : 1400-6.
M
ISE AU POINT
1
/
4
100%