thématique D La peau du transplanté

DOSSIER
tmiqu
Le Courrier de la Transplantation - Volume X - n
o 2 - avril-mai-juin 2010
63
La peau
du transplanté
Deuxième partie :
aspects cancérologiques
Coordinateur :
C. Francès
La maladie de Kaposi (MK) est une prolifération tumorale
multicentrique survenant après transplantation d’organe
chez un patient infecté par le virus herpès 8 (HHV-8)
avec une immunosuppression iatrogène. La distribution
de l’infection HHV-8 est hétérogène dans le monde avec
des pays à endémicité forte (Afrique subsaharienne),
moyenne (pays du Bassin méditerranéen, Amérique du
Sud) ou faible (Europe du Nord, États-Unis). Le trans-
planté avec MK est généralement infecté par HHV-8
avant la transplantation. Les lésions dermatologiques
sont aisément reconnaissables sur les peaux claires, avec
une évolution parallèle à celle des lésions viscérales. Les
lésions viscérales sont princi palement localisées dans le
tube digestif, les ganglions et le poumon. Les examens
virologiques sont d’une utilité limitée pour la prise en
charge de la MK. Le traitement immunosuppresseur est
diminué, sans risque pour le greffon. Si possible, les anti-
calcineurines sont remplacés par les inhibiteurs de mTOR.
Les traitements spéciques ne sont prescrits qu’en cas
de gêne esthétique ou fonctionnelle et en cas de risque
vital. Le but n’est pas d’obtenir une rémission complète
mais de stabiliser la maladie de manière à ce qu’elle soit
compatible avec une vie la plus normale possible.
Mots-clés : Virus herpès humain de type 8
◆–◆
Maladie de
Kaposi
◆–
Transplantation d’organe
◆–◆
Traitement immuno-
suppresseur.
RÉSUMÉ SUMMARY
◆Kaposi’s◆sarcoma◆(KS)◆in◆organ◆transplant◆recipi-
ents◆consists◆of◆an◆opportunistic◆multicentric◆prolif-
eration◆occurring◆in◆a◆patient◆infected◆by◆human◆
herpes◆virus◆8◆with◆a◆iatrogenic◆immunosuppression.◆
Distribution◆of◆HHV-8◆around◆the◆world◆is◆hetero-
genous◆with◆highly◆(Sub◆Saharan◆Africa),◆medium◆
(Mediterranean◆areas,◆South◆America)◆and◆low◆
infected◆countries◆(Northern◆Europe,◆USA).◆Organ◆
recipients◆with◆KS◆are◆usually◆HHV-8◆infected◆
before◆transplantation.◆Dermatologic◆lesions◆are◆
easily◆recognizable◆on◆fair◆skin.◆Their◆evolution◆runs◆
in◆parallel◆with◆those◆of◆◆extracutaneous◆KS,◆most◆
frequently◆observed◆in◆the◆gastrointestinal◆tract,◆
lymph◆nodes◆and◆lungs.◆Virological◆tests◆are◆not◆
relevant◆for◆the◆management◆of◆KS.◆Imunosup-
pressive◆drugs◆have◆to◆be◆tapered◆to◆the◆lowest◆
possible◆level,◆whilst◆attempting◆to◆keep◆the◆allograft◆
functional.◆If◆possible,◆anticalcineurin◆drugs◆are◆
switched◆with◆mTOR◆antagonist.◆Specic◆therapy◆
for◆KS◆is◆only◆prescribed◆in◆case◆of◆esthetic◆or◆
functional◆trouble◆and◆vital◆risk.◆The◆aim◆of◆this◆
management◆is◆not◆to◆obtain◆a◆complete◆remission◆
but◆a◆stabilization◆of◆KS◆with◆a◆normal◆life.
Keywords:
Human◆herpes◆virus◆8◆–◆Kaposi’s◆
sarcoma◆–◆Organ◆transplantation◆–◆Immunosup-
pressive◆therapy.
La maladie de Kaposi
Kaposi’s sarcoma
◆●Camille◆Francès*,◆Celeste◆Lebbé**
*● Service● de● dermatologie-allergologie,●
hôpital●Tenon,●Paris.
**●Service●de●dermatologie,●hôpital●Saint-
Louis,●Paris.
L
a maladie de Kaposi (MK) corres-
pond à une prolifération tumorale
opportuniste multicentrique et
de cellules dérivées de l’endothélium
lymphatique, infectées par le virus
herpès humain 8 (HHV-8). L’infection
HHV-8 et l’immunodépression plus ou
moins sélective sont indispensables à son
développement (1, 2). Ces deux éléments
sont présents dans les quatre formes
clinico-épidémiologiques de MK : la
forme classique, initialement décrite par
Moritz Kaposi et affectant typiquement
les hommes âgés du Bassin méditerra-
néen, la forme endémique présente en
Afrique subsaharienne, la forme épidé-
mique chez les patients infectés par le
VIH, et, enn, la MK compliquant une
immunosuppression iatrogène, notam-
ment après transplantation d’organe (3).

DOSSIER
tmiqu
Le Courrier de la Transplantation - Volume X - n
o 2 - avril-mai-juin 2010
64
ÉPIDÉMIOLOGIE DU VIRUS HHV-8
ET DE LA MK
HHV-8 est un gamma herpesvirus
(rhadinovirus) proche du virus
d’Epstein-Barr (EBV) et de divers
rhadinovirus infectant les macaques et
les singes verts africains. Comme tous
les herpesvirus, HHV-8 possède deux
cycles de réplication ; un cycle latent
et une phase de réplication lytique.
In vitro et in vivo, l’infection HHV-8
persiste essentiellement sous un mode
latent, mais la minorité de cellules
hébergeant le virus lytique joue proba-
blement une rôle physiopathologique
important dans la propagation de l’in-
fection virale (4). In vivo, le réservoir
majoritaire de HHV-8 est représenté par
les lymphocytes B CD19 ; néanmoins,
HHV-8 peut aussi infecter les cellules
endothéliales, les cellules fusiformes
des lésions kaposiennes, ainsi que les
cellules de l’oropharynx, par lesquelles
se propage probablement l’infection.
La distribution géographique d’HHV-8
est assez hétérogène dans le monde.
Dans les zones de forte prévalence
HHV-8 (Afrique subsaharienne), plus
de 50 % de la population est contaminée,
le plus souvent asymptomatique. Dans
les zones d’endémicité moyenne comme
l’Italie du Sud, les pays du Bassin
méditerranéen et l’Amérique du Sud,
la séroprévalence est de 10 à 20 %, alors
qu’elle est faible dans les pays d’Europe
du Nord ou aux États-Unis (moins de
5 %) [5].
La prévalence de la MK après trans-
plantation d’organe (tableau) varie
davantage selon la séroprévalence
HHV-8 des receveurs que selon celle
des donneurs (6-14). En effet, dans la
grande majorité des cas, la MK fait suite
à la réactivation d’une infection HHV-8
acquise précédemment à la greffe. Une
étude française récente a estimé à 13 %
le risque de développer une MK chez
les receveurs préalablement infectés
par HHV-8 3 ans après la transplanta-
tion (15). Les facteurs statistiquement
associés à la MK étaient la peau noire et
l’âge au moment de la transplantation.
Parfois, la MK se développe suite à une
primo-infection HHV-8 transmise par
le donneur. Alors que la séroconversion
HHV-8 à partir d’un donneur positif
semble fréquente (estimée à 31 % dans
une étude nationale française récente),
celle-ci est le plus souvent asympto-
matique (95 %) [15]. Quel que soit le
mode de contamination de l’HHV-8,
les hommes sont plus souvent atteints
par la MK, avec des ratios H/F variant
de 2 à 40 (3).
Le risque de MK est maximal dans les
2 ans qui suivent la greffe (16), le délai
médian de survenue étant de 13 mois
après la greffe, avec des extrêmes
compris entre quelques semaines et
18 ans (16). Les études comparant la
prévalence de la MK postgreffe selon
l’organe transplanté sont contradictoires
mais suggèrent des taux comparables en
transplantation rénale et en transplanta-
tion cardiaque, quoique plus importants
dans certaines séries, en transplantation
hépatique (3).
PHYSIOPATHOLOGIE
L’apparition d’une MK après transplan-
tation résulte d’un déséquilibre entre
les défenses immunitaires vis-à-vis
d’HHV-8 et l’expansion de progéni-
teurs tumoraux infectés par HHV-8. La
diminution des réponses T spéciques du
virus HHV-8 des transplantés dévelop-
pant une MK a récemment été démontrée
(17-19). Le caractère initialement clonal
de la MK est encore débattu. Il semble
cependant probable que la maladie soit
initialement polyclonale et que des pres-
sions de sélection diverses favorisent
la prolifération d’un nombre limité de
clones (20).
En dehors des gènes de structure, HHV-8
possède tout un panel de gènes, latents
ou lytiques, susceptibles d’interférer
avec la survie cellulaire, l’angiogenèse
et les réponses immunes (21, 22). Ainsi
la v-cycline, homologue des cyclines
cellulaires de type D, est exprimée dans
la plupart des cellules fusiformes kapo-
siennes, conduisant à la progression non
contrôlée de G1 en phase S. L’antigène
nucléaire de latence (LANA, Latency-
associated nuclear antigen) stimule
le cycle cellulaire, bloque l’apoptose
médiée par p53, et inter agit avec d’autres
facteurs cellulaires impliqués dans la
transcription tels que CBP, RING3, Ets1
et mSin3A. LANA s’associe également
avec GSK-3 bêta, important modulateur
de la voie Wnt. La protéine vBcl-2, codée
par l’ORF16, est un facteur inhibant
l’apoptose, exprimé à des phases avan-
cées de la MK. D’autres protéines virales
telles que v-FLIP inhibent l’apoptose.
Tableau. Prévalence de la maladie de Kaposi selon les pays et selon le type d’organe greffé.
Origine
(référence)
Rein
% (n de pt) Cœur
% (n de pt) Foie
% (n de pt) Tout organe
% (n de pt)
France (6) 0,45 (6 229) 0,41 (967) 1,24 (727) 0,52 (7 923)
Espagne (7) 0,5 (1 230) 4 (528)
Italie (9) 1,5 (2 119) 1,9 (1 447) 0,8 (957) 1,5 (4 767)
Arabie
saoudite (10) 0,45 (2 211)
Iran (11) 0,7 (7 939)
Brésil (12) 0,3 (1 300)
États-Unis (13) 0,02 (316 607)
Canada
(Toronto) [14] 0,54 (1 300) 0,54 (189) 0,94 (426) 0,57 (2 099)

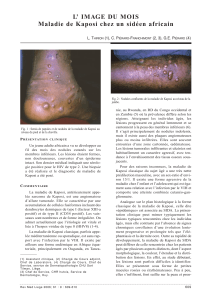
Figure 1. Maladie de Kaposi nodulaire sur
peau blanche.
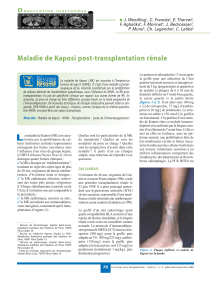
Figure 3. Lésion de Kaposi sur la cicatrice
d’une transplantation hépatique.
Figure 2. Multiples lésions papuleuses de
Kaposi sur peau noire.
DOSSIER
tmiqu
Le Courrier de la Transplantation - Volume X - n
o 2 - avril-mai-juin 2010
65
HHV-8 code pour trois chemokines
douées de propriétes angiogéniques
ainsi que pour un homologue de l’in-
terleukine 6 exprimée au cours de la
maladie de Castleman multicentrique,
mais peu dans les lésions kaposiennes.
HHV-8 possède enn une autre protéine
très angiogénique codée par l’ORF 74
qui stimule la secrétion de VEGF et de
cytokines pro-inammatoires. Des souris
transgéniques pour l’ORF74 dévelop-
pent une maladie cutanée et viscérale
similaire à la MK.
HHV-8 possède par ailleurs de nombreux
gènes régulant les réponses immunes
innées et adaptatives dont nous ne cite-
rons que des exemples. Ainsi, deux
protéines transmembranaires, MIR1 et
MIR2, inhibent l’expression des anti-
gènes HLA de classe I. L’ ORF4 code
pour une protéine qui inhibe le dépôt
de C3 à la surface cellulaire. HHV-8 a
conçu de multiples mécanismes pour
inhiber les réponses cellulaires à l’in-
terféron α.
CARACTÉRISTIQUES CLINIQUES
Des lésions cutanéomuqueuses sont
présentes dans plus de 90 % des cas.
Elles sont similiares à celles décrites
au cours des autres formes de MK. Les
lésions élémentaires sont des macules
réalisant des plaques érythémateuses
et violines s’inltrant progressivement.
Leur reconnaissance est aisée sur peau
blanche du fait de leur couleur, plus dif-
cile sur peau noire, la couleur violine
apparaissant alors plus fonçée que la
peau saine (figures 1 et 2). La présence
des lésions sur les zones traumatisées
(phénomène de Koebner) corroborerait
leur présence sur les cicatrices (figure 3).
Ces lésions ne disparaissent pas à la
vitropression et prennent volontiers un
aspect ecchymotique, hémorragique ou
pigmenté. Des nodules angiomateux de
consistance dure peuvent s’y associer ou
s’observer de façon isolée, ou plus rare-
ment des nodules lymphangiectasiques
de consistance mollasse. Un lymphœ-
dème peut accompagner les lésions,
voire les précéder et être au premier
plan (23). Aussi, un œdème uni- ou
bilatéral doit systématiquement faire
évoquer chez un transplanté HHV-8+
l’apparition d’une MK. Dans la bouche,
les lésions prédominent au palais tout
en étant ubiquitaires, parfois à l’origine
d’hypertrophie gingivale. Les lésions
génitales sont plus rares, surtout chez
la femme.
En dehors du revêtement cutanéomu-
queux, la MK atteint essentiellement
le tractus digestif (essentiellement
estomac et duodénum), les ganglions et
les poumons, dans respectivement 50 %,
20 % et 20 % des cas (23). En fait, tous
les organes peuvent être atteints.
DIAGNOSTIC
(3)
Quelle que soit la localisation, le
diagnostic de MK doit être conrmé
histologiquement. Plusieurs formes
histologiques sont décrites :
✓
MK inammatoire avec présence de
fentes vasculaires associées à un petit
infiltrat inflammatoire et à un dépôt
d’hémosidérine (témoin de l’extrava-
sation de globules rouges) dans le derme
superciel ;
✓MK à cellularité mixte avec en plus
des fentes vasculaires irrégulières et des
dépôts d’hémosidérine, un inltrat de
cellules fusiformes dans l’ensemble du
derme ;
✓
MK sarcomateuse avec une proliféra-
tion conjonctive d’architecture fasciculée
composée de cellules fusiformes aux
noyaux augmentés, de volume irrégu-
lier, souvent en mitoses.
Les cellules fusiformes kaposiennes
sont positives en immunohistochimie
pour les marqueurs de cellules endo-
théliales tels que le CD31 et le CD34,
et leur origine endothéliale lympha-
tique est hautement probable, comme
en témoigne l’expression du VEGFR3
et de la podoplanine. Ces cellules
kaposiennes fusiformes ou entourant
les pseudofentes vasculaires expriment
l’antigène de latence du virus HHV-8
(LANA). Cette expression varie en fonc-
tion de la “masse tumorale” des cellules
kaposiennes, présente dans moins de
10 % des cellules des formes inamma-
toires et dans plus de 90 % des cellules
des formes sarcomateuses.

DOSSIER
tmiqu
Le Courrier de la Transplantation - Volume X - n
o 2 - avril-mai-juin 2010
66
BILAN INITIAL
L’examen clinique initial devant un
transplanté suspect de MK doit naturelle-
ment être complet, incluant l’examen de
tout le revêtement cutanéomuqueux avec
un examen ORL et ophtalmologique.
Des photographies ou des schémas des
lésions cliniques permettront le suivi
des lésions.
Le bilan d’extension comporte un
scanner thoraco-abdomino-pelvien et
une exploration endoscopique diges-
tive haute. La bronchoscopie avec
lavage n’est proposée qu’en présence
d’anomalies au scanner thoracique. La
colonoscopie sera faite en fonction de
la symptomatologie d’appel.
Il est indispensable de rechercher systé-
matiquement une infection opportuniste
associée à la MK, car son traitement peut
faire disparaître la MK, surtout en cas
de tuberculose.
L’association à un lymphome des
séreuses sera évoquée devant des épan-
chements pleuraux récidivants avec
une virémie très élevée dans le liquide
pleural (24). Les autres associations de
maladies liées à l’infection HHV-8 sont
plus rares : maladie de Castleman multi-
centrique, lymphomes plasmablastiques,
hypoplasie médullaire et/ou syndrome
d’activation macrophagiques.
INTÉRÊT
DES EXAMENS VIROLOGIQUES
Sérologie
La sérologie HHV-8 est constamment
positive au cours d’une MK détectée par
au moins l’une des nombreuses tech-
niques disponibles. La valeur de cette
sérologie pour le suivi des transplantés
à l’échelon individuel reste discutée. Les
tests sérologiques utilisent des techniques
d’immunouorescence, de Western Blot
ou d’ELISA pour détecter des anticorps
dirigés contre des antigènes latents ou
lytiques d’HHV-8. Les tests d’immu-
nofluorescence utilisent des cellules
dérivées de lymphome des séreuses en
culture mises en contact avec le sérum
des patients, à différentes dilutions. Ces
lignées, expriment majoritairement des
antigènes de latence. La réactivité est
caractérisée par un marquage nucléaire
moucheté. Une réactivation virale peut
être induite dans ces lignées, conduisant
à l’expression d’antigènes lytiques. L’im-
munouorescence lytique est caractérisée
par une uorescence homogène cytoplas-
mique. Les tests d’IF lytiques sont plus
sensibles mais moins spéciques que les
tests d’IF latents (22).
Des tests ELISA ont été développés ;
certains utilisent des antigènes d’HHV-8
puriés tels que les produits des ORFs26,
65,73 ou K8.1 ; d’autres utilisent des
lysats viraux.
PCR
La détection, et éventuellement la quan-
tication de séquences nucléiques spéci-
ques d’HHV-8 par PCR dans les tissus,
est parfois utile pour le diagnostic de
MK cutanée ou viscérale. La quanti-
cation de la virémie HHV-8 dans le sang
circulant n’a pas d’intérêt individuel
pour le suivi d’une MK. En revanche,
des virémies élevées sont statistique-
ment associées aux MK évolutives.
La virémie HHV-8 fait partie du bilan
d’exploration d’une èvre, d’une cyto-
pénie, d’une cytolyse ou d’un syndrome
d’activation macrophagique inexpliqués,
surtout chez les transplantés préalable-
ment séropositifs avant greffe ou chez les
transplantés avec un donneur séropositif
pour HHV-8 (3).
TRAITEMENT
DE LA MALADIE DE KAPOSI
La pierre angulaire du traitement de
la MK après transplantation d’organe
repose sur la minimisation de l’immu-
nosuppression, permettant le contrôle de
la prolifération kaposienne et le maintien
de la fonctionnalité du greffon. Toute
infection opportuniste concomittante,
pouvant majorer l’immunosuppression,
sera systématiquement traitée. S’il n’y
a pas de parallélisme entre l’extension
de l’atteinte cutanée et la sévérité des
atteintes viscérales, leur évolution est
généralement corrélée, d’où l’intérêt
d’une évaluation objective de la progres-
sion ou de la régression des lésions
dermatologiques. L’objectif n’est pas
d’obtenir la rémission complète mais de
contrôler la maladie. En effet, la stabi-
lisation de la MK chez un patient ne
presentant pas ou peu de gêne fonction-
nelle semble préférable à une rémission
complète au prix d’un rejet de l’organe
transplanté.
Le pourcentage de rémission après
simple levée des immunosuppresseurs
a été estimé dans le registre de Cincinatti
aux alentours de 17 % des 213 patients
avec atteinte cutanée isolée, et 16 %
des 343 patients avec atteinte viscé-
rale associée (13). Cette estimation est
probablement sous-évaluée, notamment
en cas d’atteinte viscérale, du fait du
délai long observé avant la stabilisation
(3,6 mois) et la rémission (11 mois) de
cette maladie après minimisation de
l’immunosuppression (23).
Plus récemment, le sirolimus et appa-
rentés ont fait la démonstration de leurs
propriétés à la fois immunosuppressives
mais aussi antinéoplasiques et antian-
giogéniques (25). Sans attendre la stabi-
lisation voire la régression des lésions
kaposiennes après simple diminution
des immunosuppresseurs, les antical-
cineurines sont souvent remplacées
après greffe rénale ou cardiaque par
un inhibiteur de mTOR. Des résultats
spectaculaires ont été observés avec des
échappements possibles de la MK après
un délai variable (26).
Les traitements spéciques de la MK
ne sont justiés en complément de ces
mesures qu’en présence d’une gêne
esthétique ou fonctionnelle et en cas de
risque vital (3). Les traitements locaux
tels que la cryothérapie, la cryochirurgie,
la destruction par les lasers CO2 ou à
colorants, ou la radiothérapie peuvent
être utiles pour des lésions limitées,
esthétiquement ou fonctionnellement

DOSSIER
tmiqu
Le Courrier de la Transplantation - Volume X - n
o 2 - avril-mai-juin 2010
67
gênantes, ne modiant pas l’évolutivité
générale de la MK. Dans les formes
sévères évolutives, deux familles de
chimiothérapie sont prescrites avec un
bon rapport bénéce/ risque : les taxanes
(paclitaxel ou docétaxel), ou les anthra-
cyclines liposomales (doxorubicine ou
daunorubicine liposomale).
Les études concernant l’efcacité des
agents antiherpétiques (foscavir, cido-
fovir, ganciclovir) sont anecdotiques et
décevantes. Leur effet prophylactique
n’est pas démontré (15).
Des espoirs sont suscités par l’arrivée
de thérapies ciblées (agents antiangio-
géniques, agents inhibant la voie NFκB,
anti-IL6, anti-STAT3).
Dans l’avenir, la modulation fine de
l’immunosuppression associée éven-
tuellement à des thérapies ciblées
devrait permettre d’améliorer encore le
pronostic de la MK après transplantation
d’organe. ■
RéféRences
bibliogRaphiques
1. Antman K, Chang Y. Kaposi’s sarcoma. N Engl
J Med 2000;342:1027-38.
2. Chang Y, Cesarman E, Pessin MS et al. Iden-
tification of herpesvirus-like DNA sequences
in AIDS-associated Kaposi’s sarcoma. Science
1994;266:1865-9.
3. Lebbe C, Legendre C, Frances C. Kaposi
sarcoma in transplantation. Transplant Rev
(Orlando) 2008;22:252-61.
4. Grundhoff A, Ganem D. Inefcient establish-
ment of KSHV latency suggests an additional role
for continued lytic replication in Kaposi sarcoma
pathogenesis. J Clin Invest 2004;113:124-36.
5. Schulz TF. Epidemiology of Kaposi’s sarcoma-
associated herpesvirus/human herpesvirus 8. Adv
Cancer Res 1999;76:121-60.
6. Farge D. Kaposi’s sarcoma in organ transplant
recipients. The Collaborative Transplantation
Research Group of Ile-de-France. Eur J Med
1993;2:339-43.
7. Mitxelena J, Gomez-Ullate P, Aguirre A,
Rubio G, Lampreabe I, Díaz-Pérez JL. Kaposi’s
sarcoma in renal transplant patients: experience
at the Cruces Hospital in Bilbao. Int J Dermatol
2003;42:18-22.
8. Marqués Medina E, Jiménez Romero C, Gómez
de la Cámara A, Rota Bernal A, Manrique
Municio A, Moreno González E. Malignancy
after liver transplantation: cumulative risk for
development. Transplant Proc 2009;41:2447-9.
9. Piselli P, Busnach G, Citterio F et al. Immu-
nosuppression and Cancer Study Group. Risk of
Kaposi sarcoma after solid-organ transplantation:
multicenter study in 4 767 recipients in Italy, 1970-
2006. Transplant Proc 2009;41:1227-30.
10. Abbaszadeh S, Taheri S. Kaposi’s sarcoma
after renal transplantation. Saudi J Kidney Dis
Transpl 2009;20:775-8.
11. Einollahi B, Lessan-Pezeshki M, Nourbala MH,
et al. Kaposi’s sarcoma following living donor
kidney transplantation: review of 7 939 recipients.
Int Urol Nephrol 2009;41:679-85.
12. Falsarella PM, Alves-Filho G, Mazzali M.
Skin malignancies in renal transplant recipients:
a Brazilian center registry. Transplant Proc
2008;40:767-8.
13. Penn I. Kaposi’s sarcoma in transplant reci-
pients. Transplantation 1997;64:669-73.
14. Shepherd FA, Maher E, Cardella C et al.
Treatment of Kaposi’s sarcoma after solid organ
transplantation. J Clin Oncol 1997;15:2371-7.
15. Francès C, Marcelin AG, Legendre C et al. The
impact of preexisting or acquired Kaposi sarcoma
herpesvirus infection in kidney transplant reci-
pients on morbidity and survival. Am J Transplant
2009;9:2580-6.
16. Francès C. Kaposi’s sarcoma after renal trans-
plantation. Nephrol Dial Transplant 1998;13:
2768-73.
17. Lambert M, Gannage M, Karras A et al. Diffe-
rences in the frequency and function of HHV8-
specific CD8 T cells between asymptomatic
HHV8 infection and Kaposi sarcoma. Blood
2006;108:3871-80.
18. Barozzi P, Bonini C, Potenza L et al. Changes
in the immune responses against human herpes-
virus-8 in the disease course of posttransplant
Kaposi sarcoma. Transplantation 2008;86:738-44.
19. Barozzi P, Riva G, Vallerini D et al. Indirect
antitumor effects of mammalian target of rapa-
mycin inhibitors against Kaposi sarcoma in trans-
plant patients. Transplantation 2009;88:597-8.
20. Duprez R, Lacoste V, Briere J et al. Evidence
for a multiclonal origin of multicentric advanced
lesions of Kaposi sarcoma. J Natl Cancer Inst
2007;99:1086-94.
21. Moore PS, Chang Y. Kaposi’s sarcoma-asso-
ciated herpesvirus immunoevasion and tumori-
genesis: two sides of the same coin? Annu Rev
Microbiol 2003;57:609-39.
22. Schulz TF. The pleiotropic effects of Kaposi’s
sarcoma herpesvirus. J Pathol 2006;208:187-98.
23. Barete S, Calvez V, Mouquet C et al. Clinical
features and contribution of virological ndings to
the management of Kaposi sarcoma in organ-allo-
graft recipients. Arch Dermatol 2000;136:1452-8.
24. Régnier-Rosencher E, Barrou B, Marcelin AG
et al. Lymphome des séreuses chez le transplanté
rénal: 2 cas. Ann Dermatol (sous presse).
25. Stallone G, Schena A, Infante B et al. Siro-
limus for Kaposi’s sarcoma in renal-transplant
recipients. N Engl J Med 2005;352:1317-23.
26. Lebbé C, Euvrard S, Barrou B et al. Sirolimus
conversion for patients with posttransplant Kapo-
si’s sarcoma.Am J Transplant 2006;6:2164-8.
1
/
5
100%